Введение. В ФГБОУ ВО СПХФУ Минздрава России проводится разработка полипилла в виде твердой желатиновой капсулы, содержащей мини-таблетки оригинальной антигипертензивной комбинации. Одним из компонентов полипилла выступает кандесартан, обладающий высокой антигипертензивной активностью и выраженными органопротективными свойствами. Учитывая, что активная фармацевтическая субстанция (АФС) кандесартана цилексетила характеризуется низкой растворимостью в воде и средах желудочно-кишечного тракта, увеличение растворимости данной субстанции способно привести к существенному повышению ее биодоступности.
Цель. Сравнительный анализ технологических подходов к повышению биодоступности труднорастворимой АФС кандесартана цилексетила в лекарственной форме мини-таблетки.
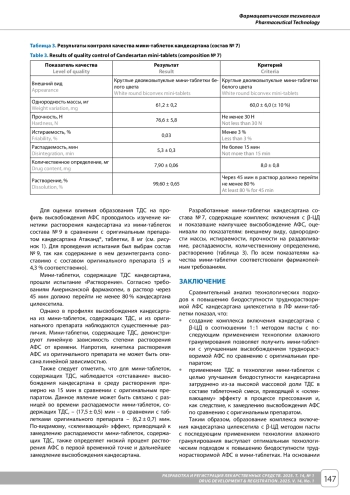
Материалы и методы. Для проведения исследования использовали АФС кандесартана цилексетила, β-циклодекстрин (β-ЦД), сополимер поливинилпирролидона и винилацетата, а также вспомогательные вещества для получения мини-таблеток, выполняющие функции наполнителей, связующего вещества, дезинтегранта, опудривающего компонента. Оценку профилей высвобождения кандесартана цилексетила из разработанных мини-таблеток проводили в сравнении с оригинальным препаратом Атаканд®, таблетки, 8 мг. Комплекс кандесартана цилексетила с β-ЦД в соотношении 1: 1 получали тремя методами: сухого смешения, методом пасты и лиофилизацией. Твердую дисперсную систему (ТДС) кандесартана получали методом экструзии горячего расплава. Полученные комплексы АФС с β-ЦД и ТДС характеризовали методами ИК-Фурье-спектрометрии и дифференциальной сканирующей калориметрии. Таблеточные смеси получали методом сухого смешения и технологией влажного гранулирования. Мини-таблетки прессовали на лабораторном автоматическом однопуансонном таблеточном прессе. Контроль качества полученных мини-таблеток осуществляли по методикам Государственной фармакопеи РФ XV издания и Американской фармакопеи.
Результаты и обсуждение. В ходе сравнительного анализа технологических подходов к повышению биодоступности кандесартана цилексетила установлено, что создание комплекса включения АФС с β-ЦД в соотношении 1: 1 методом пасты с последующим применением технологии влажного гранулирования позволило получить мини-таблетки с улучшенным высвобождением труднорастворимой АФС по сравнению с оригинальным препаратом. Напротив, применение ТДС в технологии мини-таблеток привело к замедлению высвобождения АФС в сравнении с оригинальным препаратом. Разработанные мини-таблетки кандесартана состава No 7 по всем показателям качества соответствовали фармакопейным требованиям.
Заключение. Создание комплекса включения АФС с β-ЦД методом пасты с последующим применением технологии влажного гранулирования является оптимальным технологическим подходом к повышению биодоступности труднорастворимой АФС кандесартана цилексетила в мини-таблетках.
Идентификаторы и классификаторы
- Префикс DOI
- 0.33380/2305-2066-2025-14-1-1883
Одним из широко используемых и представляющих научный и практический интерес способов повышения биодоступности труднорастворимых веществ является комплексообразование с циклодекстринами (ЦД) [5–7]. ЦД, как нативные, так и модифицированные, обладают способностью образовывать комплексы включения с различными органическими молекулами путем молекулярной инкапсуляции, что приводит к повышению растворимости и стабильности АФС [5, 8].
Список литературы
1. Bhalani D. V., Nutan B., Kumar A., Singh Chandel A. K. Bioavailability Enhancement Techniques for Poorly Aqueous Soluble Drugs and Therapeutics. Biomedicines. 2022;10(9):2055. https://doi.org/10.3390/biomedicines10092055.
2. Tran P., Pyo Y.-C., Kim D.-H., Lee S.-E., Kim J.-K., Park J.-S. Overview of the Manufacturing Methods of Solid Dispersion Technology for Improving the Solubility of Poorly Water-Soluble Drugs and Application to Anticancer Drugs. Pharmaceutics. 2019;11(3):132. https://doi.org/10.3390/pharmaceutics11030132.
3. Mahmood T., Sarfraz R. M., Ismail A., Ali M., Khan A. R. Pharmaceutical Methods for Enhancing the Dissolution of Poorly Water-Soluble Drugs. ASSAY and Drug Development Technologies. 2023;21(2):65-79. https://doi.org/10.1089/adt.2022.119.
4. Гулякин И. Д., Николаева Л. Л., Оборотова Н. А., Дмитриева М. В., Ланцова А. В., Санарова Е. В., Орлова О. Л., Полозкова А. П., Лаврухин Н. И., Бунятян Н. Д. Основные методы повышения растворимости гидрофобных и труднорастворимых веществ. Разработка и регистрация лекарственных средств. 2016;(2):52-59.
5. Kim D.-H., Lee S.-E., Pyo Y.-C., Tran P., Park J.-S. Solubility enhancement and application of cyclodextrins in local drug delivery. Journal of Pharmaceutical Investigation. 2020;50:17-27. https://doi.org/10.1007/s40005-019-00434-2.
6. Carneiro S. B., Costa Duarte F. I., Heimfarth L., de Souza Siqueira Quintans J., Quintans-Júnior L. J., da Veiga Júnior V. F., de Lima Á. A. N. Cyclodextrin-Drug Inclusion Complexes: In Vivo and In Vitro Approaches. International Journal of Molecular Sciences. 2019;20(3):642. https://doi.org/10.3390/ijms20030642.
7. Кедик С. А., Панов А. В., Тюкова В. С., Золотарева М. С. Циклодекстрины и их применение в фармацевтической промышленности (обзор). Разработка и регистрация лекарственных средств. 2016;(3):68-75.
8. Савельева Е. И. Современные технологии модифицированного высвобождения биологически активных веществ в фармацевтической разработке (обзор). Разработка и регистрация лекарственных средств. 2020;9(2):56-66. https://doi.org/10.33380/2305-2066-2020-9-2-56-66.
9. Гусев К. А., Маймистов Д. Н., Павловский В. И., Алиев А. Р., Павловский А. В., Иванова О. В., Цыренов Д. О., Флисюк Е. В. Разработка состава и технологии получения твердой дисперсной системы методом экструзии горячего расплава для повышения биодоступности действующего вещества. Разработка и регистрация лекарственных средств. 2022;11(4):108-115. https://doi.org/10.33380/2305-2066-2022-11-4-108-115.
10. Schittny A., Huwyler J., Puchkov M. Mechanisms of increased bioavailability through amorphous solid dispersions: a review. Drug Delivery. 2020;27(1):110-127. https://doi.org/10.1080/10717544.2019.1704940.
11. Церковная К. М., Флисюк Е. В., Коцур Ю. М., Наркевич И. А., Смехова И. Е., Ивкин Д. Ю., Филимонова Н. В. Разработка мини-таблеток амлодипина как компонента полипилла для персонализированной терапии артериальной гипертензии. Разработка и регистрация лекарственных средств. 2023;12(4):155-164. https://doi.org/10.33380/2305-2066-2023-12-4-1523.
12. Messerli F. H., Bangalore S., Rimoldi S. F., Gąsowski J., Nussberger J. Are ACE inhibitors acceptable ingredients in polypills? The Lancet. 2017;390(10089):26. https://doi.org/10.1016/S0140-6736(17)31468-X.
13. Задионченко В. С., Щикота А. М., Ялымов А. А., Шехян Г. Г., Тимофеева Н. Ю., Оганезова Л. Г., Терпигорев С. А., Кабанова Т. Г., Никишенков А. М. Алгоритм выбора препарата для лечения артериальной гипертонии. Русский медицинский журнал. 2017;4:296-301.
14. Карпов Ю. А., Мелехов А. В. Кандесартан: выход за пределы сердечно-сосудистого континуума. Атмосфера. Новости кардиологии. 2019;2:31-40.
15. Гусев К. А., Алиев А. Р., Генералова Ю. Э., Аксенова Н. А., Речкалов Г. В., Маймистов Д. Н., Алексеева Г. М., Флисюк Е. В. Разработка состава и технологии получения аморфной твердой дисперсной системы эбастина методом экструзии горячего расплава для увеличения скорости растворения. Разработка и регистрация лекарственных средств. 2023;12(4):126-135. https://doi.org/10.33380/2305-2066-2023-12-4-1577.
16. Смехова И. Е., Вайнштейн В. А., Ладутько Ю. М., Дружининская О. В., Турецкова Н. Н. Дезинтегранты и их влияние на растворение субстанций разных классов по биофармацевтической классификационной системе. Разработка и регистрация лекарственных средств. 2018;(4):62-72.
17. Aly U. F., Sarhan H. A., Ali T. F. S., Sharkawy H. A. E. Applying Different Techniques to Improve the Bioavailability of Candesartan Cilexetil Antihypertensive Drug. Drug Design, Development and Therapy. 2020;14:1851-1865. https://doi.org/10.2147/DDDT.S248511.
18. Salih O. S., Hamoddi Z. M., Taher S. S. Development and Characterization of Controlled Release Tablets of Candesartan Cilexetil/ β-Cyclodextrin Inclusion Complex. International Journal of Drug Delivery Technology. 2020;10(2):273-283. https://doi.org/10.25258/ijddt.10.2.15.
Выпуск
Другие статьи выпуска
Введение. Проблема отсутствия эффективного и безопасного фармакологического средства смягчения последствий воздействия ионизирующего излучения становится все более актуальной. Ее решение затруднено по причине высокой химической токсичности всех известных по-настоящему эффективных радиопротекторов. Сейчас большое внимание уделяется изучению радиозащитных свойств так называемых природных соединений. Но в большинстве данных работ экспериментальная модель подвергалась единоразовому острому облучению. В то же время безопасный и эффективный радиозащитный препарат в условиях фракционированного облучения будет полезен при лучевой терапии онкологических заболеваний и при выполнении космических миссий, а также в условиях радиационного загрязнения территорий.
Цель. Сравнение радиозащитного эффекта медного хлорофиллина, рибоксина, также называемого инозином, и совместного применения глутатиона и аскорбиновой кислоты с таковым для эталонного российского радиопротектора индралина при фракционированном воздействии рентгеновским излучением.
Материалы и методы. Самцы мышей ICR (CD-1) были подвергнуты пяти ежедневным облучениям в дозе 2,5 Гр. В дни каждого облучения экспериментальным животным вводились хлорофиллин (20 мкг/г), индралин (50 мкг/г) в растворе винной кислоты или глутатион (250 мкг/г) и аскорбиновая кислота (150 мкг/г) перед облучением или рибоксин (200 мкг/г) после облучения. Выживаемость мышей оценивалась в течение 30 суток после последнего облучения.
Результаты и обсуждение. Только применение рибоксина обеспечило выживаемость 10 % облученных животных, однако без статистически значимого повышения средней продолжительности жизни погибших особей относительно группы интактных мышей. Значимое повышение данного параметра обеспечило только использование индралина. Медный хлорофиллин не оказал радиозащитного действия. Возможно, применение безметаллических производных хлорофилла в будущем сможет оказать радиопротекторное действие в данных условиях. Совместное применение глутатиона и аскорбиновой кислоты привело к гибели 2 из 10 мышей в период облучений и введений препаратов, не обеспечив повышения выживаемости в период наблюдений.
Заключение. Применение медного хлорофиллина и глутатиона с аскорбиновой кислотой не обеспечило повышения выживаемости и средней продолжительности жизни умерших мышей, подвергнутых облучению в дозе 12,5 Гр, распределенной на 5 фракций по 2,5 Гр. Применение индралина повысило только продолжительность жизни павших животных. Рибоксин способствовал выживанию 10 % соответствующей группы.
Введение. Для изучения механизмов развития депрессии и оценки антидепрессивного эффекта новых соединений используют разные животные модели, среди которых модели социального взаимодействия, основанные на действии эмоциональных стрессоров, характеризуются наиболее высокой конструктивной, наглядной и предиктивной валидностью. Модель депрессии у крыс, базирующаяся на повторяющемся опыте социальных поражений, позволяет индуцировать депрессивноподобное состояние, максимально приближенное к депрессии у человека, и оценивать эффект новых веществ с антидепрессивной активностью.
Цель. Исследовать антидепрессивный эффект 3-этокситиетан-1,1-диоксида (3ЭТД) на модели зоосоциального взаимодействия у крыс.
Материалы и методы. Белые неинбредные крысы-самцы массой 200–250 г (интрудеры) ежедневно на протяжении 24 дней получали 3ЭТД (2 мг/кг, группы «3ЭТД» и «Стресс + 3ЭТД») или физиологический раствор (группы «Контроль» и «Стресс») в/б. Через 30 минут после введения животные групп «Стресс» и «Стресс + 3ЭТД» подвергались 10-минутным конфронтациям с резидентами (неинбредными крысами-самцами массой 350–400 г). На +23 сутки оценивали развитие депрессивноподобного состояния у интрудеров всех групп в тесте «принудительное плавание», на +24 проводили тесты «открытое поле» и «приподнятый крестообразный лабиринт». Ежедневно регистрировали массу тела интрудеров и количество потребленного корма, по окончании эксперимента – весовые коэффициенты их внутренних органов.
Результаты и обсуждение. Длительная повторяющаяся конфронтация с резидентами приводила к развитию депрессивноподобного состояния у интрудеров к +23 суткам. 3ЭТД проявлял антидепрессивные свойства, устраняя последствия социального стресса у интрудеров: статистически значимо снижал поведение отчаяния в тесте «принудительное плавание», повышал исследовательскую, социальную и двигательную активность животных, долю активных форм защитного поведения, снижая долю пассивных форм, в ходе взаимодействия с резидентами и не влиял на прирост массы тела и потребление пищи.
Заключение. 3ЭТД при ежедневном внутрибрюшинном введении в дозе 2 мг/кг на протяжении 24 суток эффективно корректирует последствия зоосоциального взаимодействия, оказывая антидепрессивное действие.
Введение. Комбинированная терапия хронической сердечной недостаточности (ХСН) является актуальной и важной стратегией лечения, поскольку она позволяет достичь улучшения прогноза, оптимального контроля симптомов заболевания и повышения качества жизни пациентов.
Цель. Сравнение эффективности производного малоновой кислоты этмабена, ингибитора натрий-глюкозного котранспортера эмпаглифлозина и их комбинаций с вариативностью стартового препарата при экспериментальной постинфарктной хронической сердечной недостаточности у крыс.
Материалы и методы. На модели постинфарктной хронической сердечной недостаточности, воспроизведенной перманентным лигированием левой коронарной артерии у крыс, методом эхокардиографического исследования была проведена сравнительная оценка монотерапии этмабеном (60 мг/кг) и эмпаглифлозином (1 мг/кг) с комбинированным режимом применения этих препаратов в течение 1 месяца. Оценка концентрации этмабена в миокарде проведена методом ВЭЖХ.
Результаты и обсуждение. Выявлен антагонизм между этмабеном и эмпаглифлозином, проявляющийся снижением эффекта комбинированной терапии по отношению к любому из компонентов, показано снижение концентрации производного малоновой кислоты в миокарде под действием ингибитора натрий-глюкозного котранспортёра 2-го типа.
Заключение. На основании полученных данных спланирован пул дополнительных исследований фармакокинетики и фармакодинамики этмабена.
Введение. Сахарный диабет II типа (СД-II) представляет собой хроническое заболевание, характеризующееся инсулинорезистентностью, нарушенной толерантностью к глюкозе и гипергликемией. СД-II является доказанным фактором риска развития как периферических нейропатий, так и нарушений мышечной сократимости и функции. Производное бигуанида метформин, экспериментальное соединение малобен и препараты различных видов женьшеня (Panax spp.) обладают значительным потенциалом для лечения СД-II и его скелетно-мышечных осложнений. В качестве теста для оценки мышечной сократимости и эффективности ее восстановления Gregory et al. был предложен протокол электростимуляционного утомления (ЭСУ), включающий измерение силы хвата перекладины после утомления двуглавой мышцы плеча высокочастотной электростимуляцией с помощью имплантированных электродов.
Цель. В настоящей работе нами была проведена оценка применимости модификации данного протокола для оценки миотропных эффектов метформина, малобена и экстрактов суспензионных культур клеток женьшеня обыкновенного Panax ginseng C. A. Mey. (ЖОЭ), ж. вьетнамского P. vietnamensis Ha & Grushv. (ЖВЭ) и ж. японского P. japonicus (T. Nees) C. A. Mey. (ЖЯЭ) у лептинрезистентных мышей db/db, являющихся одной из наиболее популярных современных моделей СД-II.
Материалы и методы. Эксперименты были выполнены на 60 молодых взрослых (2 мес.) мышах-самцах линии C57Bl/Ks-db+ /+m (db/db) массой 45–50 г, рандомизированных на 6 групп: 1) контроль (n = 10; 0,9 % физиологический раствор); 2) ЖОЭ (n = 10; 50 мг/кг); 3) ЖВЭ (n = 10; 50 мг/кг); 4) ЖЯЭ (n = 10; 50 мг/кг); 5) малобен (n = 10; 60 мг/кг); 6) метформин (n = 10; 300 мг/кг). Все препараты вводили внутрижелудочно с помощью зонда 1 р/д в течение 2 мес. По окончании периода лечения измеряли силу хвата (г) передними и всеми четырьмя конечностями с помощью аппарата Grip Strength Meter (TSE Systems, Германия). Методом стимуляционной электронейромиографии анализировали амплитуду М-ответов икроножной мышцы на стимуляцию седалищного нерва одиночными стимулами, а также регистрировали изменение амплитуды М-ответов в течение 5 мин после проведения ЭСУ.
Результаты и обсуждение. По окончании периода лечения не наблюдали значимых межгрупповых различий в силе хвата и амплитуде М-ответов икроножной мышцы при ее стимуляции одиночными стимулами. Контролируемое ЭСУ мышцы приводило к снижению амплитуды ее М-ответа на 18,83–35,23 % от исходного уровня (p < 0,01 для всех групп), причем выраженность этого снижения была значимо меньше в группах ЖВЭ, ЖЯЭ и малобена по сравнению с контролем (p < 0,05). Восстановительный период (5 мин) после ЭСУ характеризовался увеличением амплитуды М-ответа на 10,18–14,79 %, имевшим статистическую значимость во всех группах, кроме ЖОЭ (p < 0,01 в группах контроля, ЖВЭ и ЖЯЭ; p < 0,05 в группах малобена и метформина). Значимые отличия от контроля по результатам восстановительного периода в опытных группах не наблюдались.
Заключение. Предлагаемый протокол ЭСУ представляет собой функциональную пробу, позволяющую оценить эффективность восстановления электрической активности скелетной мышцы после ее контролируемого утомления. Применение описываемого протокола позволило выявить положительное влияние ЖВЭ, ЖЯЭ и малобена, но не ЖОЭ и метформина на краткосрочное восстановление сократимости икроножной мышцы после тетанизации у диабетических мышей db/db. Проба с ЭСУ чувствительна к миотропным эффектам препаратов метаболического действия, сравнительно малоинвазивна и подходит для использования в хроническом эксперименте.
Введение. Неалкогольная жировая болезнь печени (НАЖБП) и неалкогольный стеатогепатит (НАСГ) – на сегодняшний день ведущая причина хронической патологии печени во всем мире – ассоциированы с широким спектром психоневрологических осложнений и заболеваний. Тем не менее в настоящий момент аспекты причинно-следственной связи между патологией печени и нервной системы изучены не до конца, что обусловливает необходимость разработки соответствующих клинически релевантных и валидных животных моделей.
Цель. Целью настоящей работы стала оценка кратко- и долгосрочных психоневрологических и периферических нейрональных нарушений, осложняющих течение различных стадий НАЖБП/НАСГ у мышей.
Материалы и методы. 68 взрослых мышей-самцов линии C57Bl/6 рандомизировали на группы «Контроль» и «НАСГ». НАСГ моделировали в течение 3 (эксперимент 1) или 6 (эксперимент 2) мес. при помощи комбинированной модели, включающей высокожировую диету и введение низких доз тетрахлорметана. Контрольные животные получали стандартный комбикорм, питьевую воду и физиологический раствор в эквивалентных объемах. Поведение животных оценивали через 1, 2, 3 и 6 мес индукции НАСГ в тестах «Открытое поле» (ОП), «Приподнятый крестообразный лабиринт» (ПКЛ) и «Черно-белая камера» (ЧБК). Визуально-пространственную память оценивали с помощью тестов «Спонтанное чередование в Т-лабиринте» и «Распознавание нового объекта» через 1, 2 и 3 мес. индукции НАСГ, а также с помощью теста «Лабиринт Барнс» через 6 мес. индукции НАСГ. Через 3 мес. моделирования НАСГ выполняли игольчатую электронейромиографию (ЭНМГ) икроножной мышцы и двуглавой мышцы плеча при электрической стимуляции седалищного и мышечнокожного нервов соответственно. Патологию печени верифицировали гистоморфологически. Статистическую обработку данных проводили в программе Prism 10.2.3 и среде R 4.2.3 с RStudio 2024.09.0.
Результаты и обсуждение. Экспериментальное моделирование сопровождалось снижением общей выживаемости животных (p < 0,05, p < 0,01) и признаками выраженного поражения печени, включая холестатический гепатит, среднеи крупнокапельный стеатоз, очаги некроза и фиброз различной степени тяжести (p < 0,05, p < 0,01). Мыши с НАСГ демонстрировали признаки повышения тревожности в тестах ОП, ПКЛ и ЧБК (p < 0,05, p < 0,01), которые были наиболее выражены на самых начальных (1 мес.) и более поздних (6 мес.) стадиях болезни. НАСГ был также ассоциирован со значительным снижением частоты спонтанного чередования в 3 мес. (p < 0,01), отрицательной дискриминацией объектов в 2 мес. (p < 0,05) и ухудшением ретенции памятного следа в «Лабиринте Барнс» (p < 0,05, p < 0,01) по сравнению с контролем. При проведении ЭНМГ в икроножной мышце у мышей с НАСГ наблюдали значительное снижение максимальной амплитуды М-ответа (p < 0,01) и пороговой силы тока (p < 0,05), в двуглавой мышце плеча – увеличение латентности максимального ответа (p < 0,05).
Заключение. Экспериментальный алиментарно-токсический НАСГ у мышей-самцов линии C57Bl/6 ассоциирован с повышением тревожности, нарушением формирования и ретенции визуально-пространственного памятного следа, а также признаками аксонально-демиелинизирующей периферической моторной нейропатии.
Введение. Неврологические заболевания занимают одно из первых мест по показателю DALY (Disability-adjusted life year) и выступают второй причиной смертности в мире. Наблюдается тенденция к омоложению и увеличению заболеваемости этой группы патологий. Лекарственная терапия, направленная на нейропротекцию и улучшение восстановления неврологических функций, согласно клиническим рекомендациям, включает в себя сукцинатсодержащий препарат – Цитофлавин®. Однако эти рекомендации основаны на очень ограниченном количестве исследований (для Цитофлавина® – 4 исследования). В связи с огромным количеством работ в области применения сукцинатсодержащих препаратов в качестве нейропротекторов, отсутствием количественной оценки результатов исследований перспективным представляется проведение систематических обзоров и метаанализов в этой области.
Цель. Оценка эффективности и безопасности применения Цитофлавина® в качестве нейропротектора на основе систематического обзора. Материалы и методы. Систематический обзор результатов исследований был проведен согласно критериям PRISMA 2020. Поиск публикаций проводили по базам данных PubMed, Medline, а также российским научным электронным библиотекам eLibrary. Ru и РИНЦ. Также осуществляли поиск материалов в системах отечественного и международного реестра клинических исследований.
Результаты и обсуждение. В обзор вошло 18 публикаций, включающих описание терапии 10 патологий неврологического генеза. Наибольшая часть исследований была посвящена терапии ишемического инсульта (n = 4/18; 22,22 %) и проявлениям когнитивной дисфункции (n = 5/18; 27,78 %). Пул материалов включал в себя разнообразные по дизайну исследования, однако большая часть была представлена открытыми сравнительными рандомизированными/ нерандомизированными исследованиями. Анализ источников показал, что положительный эффект при применении Цитофлавина® и целесообразность включения его в схему терапии отмечается во всех публикациях. Однако многие исследования имеют низкую статистическую мощность ввиду маленьких размеров выборок пациентов, их гетерогенности и неполноты представления данных о лечении, отсутствия рандомизации.
Заключение. По результатам большинства клинических исследований показано, что применение Цитофлавина® является безопасным, а его назначение при неврологических заболеваниях различного генеза является целесообразным в связи со снижением частоты неблагоприятных неврологических исходов у пациентов. Для объективного результата исследований требуется проведение метааналитической оценки включенных в обзор публикаций.
Введение. В связи с повышением резистентности к антимикробным препаратам разного спектра действия у населения вопрос поиска новых препаратов, обладающих антимикробной активностью, в настоящий момент наиболее актуален. Мята перечная (Mentha piperita L.) известна своими лекарственными свойствами, которые обусловлены наличием в лекарственном растении различных биологически активных соединений. Извлечения из листьев мяты перечной содержат в своем составе эфирное масло, основным компонентом которого является ментол, а также нелетучие фенольные соединения – флавоноиды (лютеолин и др.) и фенилпропаноиды (розмариновая кислота, сальвианоловая кислота, хлорогеновая кислота и др.).
Цель. Сравнительное исследование противомикробной активности экстрактов из образцов исследуемого растительного сырья и проведение их качественного анализа методом высокоэффективной жидкостной хроматографии (ВЭЖХ).
Материалы и методы. Объектами исследования являлись водно-спиртовые извлечения на 70%-м этиловом спирте исследуемого растительного сырья. Определение минимальной ингибирующей концентрации проводили методом двойных серийных разведений в питательном бульоне Мюллера – Хинтон (Bio-Rad, США). В качестве тестовых культур использовали штаммы Staphylococcus aureus (АТСС 29213), Bacillus cereus (АТСС 29213), Candida albicans (ATCC 90028), Escherichia coli (АТСС 25922), Pseudomonas aeruginosa (АТСС 27853). Хроматографический анализ осуществляли методом ВЭЖХ на микроколоночном жидкостном хроматографе «Милихром-6» (НПАО «Научприбор») в следующих условиях: градиентный режим, стальная колонка КАХ-6-80-4 (No 2; 2 × 80 мм; Сепарон-C18, 7 мкм); элюентная система: ацетонитрил (ПФА) – 1%-й раствор уксусной кислоты (ПФБ) (1: 9; 2: 8; 3: 7; 8: 2), скорость элюирования – 100 мкл/мин, объем элюента – 2500 мкл. Детекцию веществ осуществляли при длине волны 330 нм. Объемы инжектируемых проб – 2 мкл.
Результаты и обсуждение. Таким образом, установлено, что все исследуемые образцы дают стабильный превалирующий антимикробный эффект в отношении штаммов тестовых культур.
Заключение. Полученные в ходе проведенного исследования данные свидетельствуют о перспективности получения лекарственных растительных препаратов на основе листьев мяты различных видов и сортов, проявляющих противомикробную активность.
Введение. Тест «Растворение» для лекарственных средств является одним из ключевых и во многом призван моделировать биодоступность действующего вещества в условиях его применения. Тем не менее существует ряд препаратов, содержащих в своем составе активные фармацевтические ингредиенты, плохо растворимые в стандартных условиях. Однако, поскольку их действие местное, плохая растворимость не сказывается отрицательно на терапевтическом эффекте. В данной работе рассмотрена разработка условий проведения теста «Растворение» в суппозиториях на липофильной основе, содержащих в своем составе натамицин, который является противогрибковым агентом, относящимся к тетраеновым макролидам, плохо растворимым в воде и, как следствие, в стандартных буферных растворах, предназначенных для проведения теста.
Цель. Подобрать оптимальные условия проведения теста «Растворение», при которых можно будет добиться полного высвобождения действующего вещества из суппозиториев на липофильной основе на примере суппозиториев «Пимафуцин» и «Примацин».
Материалы и методы. Объектами исследования являются суппозитории на липофильной основе, содержащие в своем составе натамицин. Исследование проводилось с использованием тестеров растворения (аппараты «Вращающаяся корзинка» и «Проточная ячейка») и системы ВЭЖХ для контроля количества высвободившегося натамицина.
Результаты и обсуждение. Объекты исследования были проанализированы с помощью теста «Растворение». В работе показана возможность проведения теста с полным высвобождением действующего вещества при добавлении поверхностно-активных веществ и органического растворителя, что допустимо для сред, применяемых для контроля качества согласно Государственной фармакопее XV издания; примеры таких сред можно найти также в базе данных сред растворения FDA.
Заключение. Разработаны условия проведения теста «Растворение» для суппозиториев, содержащих в своем составе натамицин.
Введение. В результате исследования методом реактивной термоэкструзии (РТЭ) было получено 4 типа гранул с индометацином на основе сополимеров Eudragit® марок ЕРО и L100-55, их физической смеси (ФС), аналогичной по составу синтезированному интерполиэлектролитному комплексу (ИПЭК) ЕРО/L100-55 – 1,95: 1 (по молям). Проведенная с использованием метода модулированной ДСК отработка условий термоэкструзии показала применимость данного подхода для предварительного моделирования происходящих процессов. Охарактеризованные с использованием методов термического и спектрального анализа полученные гранулы включают индометацин в аморфной форме, образующейся из исходной γ-формы в результате РТЭ образцов. Изучение высвобождения индометацина из полученных гранул в моделирующих продвижение по ЖКТ условиях показало перспективность всех видов разработанных систем для создания конструкций с направленным высвобождением ЛВ в модельные буферные среды, соответствующие голодному или сытому желудку, а также верхним отделам тонкой кишки (ЕРО и ФС ЕРО/L100-55), слепой и правой половины толстой кишки (L100-55) и проксимального отдела толстой кишки (ИПЭК). В последнее время вследствие выраженной пластичности, обусловленной низкой температурой стеклования (Тс), многие типы сополимеров Eudragit® (Е, RL, RS, FS, NE, NM) находят все более широкое применение в интенсивно развивающейся области фармацевтической технологии – гранулировании методом термоэкструзии, получившей название pharmaceutical melt extrusion (PME). Несмотря на прогрессирующее количество исследований по использованию PME-метода, исследования по изучению возможности применения поликомплексных систем на основе сополимеров семейства Eudragit® незаслуженно отсутствуют. При этом известно, что комбинирование противоположно заряженных пар термопластичных эудрагитов при использовании технологии термоэкструзии позволяет разрабатывать пероральные системы доставки с регулируемой проницаемостью полимерных звеньев в структуре оболочек пеллет вследствие образования интерполимерно связанных участков цепей реагирующих макромолекул в процессе высвобождения лекарственных веществ (ЛВ) в моделирующих желудочно-кишечный тракт (ЖКТ) средах с прогрессирующим ростом значений рН от желудка до толстой кишки. К сожалению, несмотря на то, что в литературе имеется множество примеров по применению метода термоэкструзии, включая и РТЭ для получения систем доставок ЛВ на основе сополимера Eudragit® ЕРО (ввиду его низкой Тс), практически отсутствуют исследования, в которых в качестве термоэкструзионного носителя использовался бы интерполиэлектролитный комплекс (ИПЭК) с участием химически комплементарных пар эудрагитов.
Цель. Разработка и исследование термоэкструдированных гранул на основе интерполимерных сочетаний анион-катионных типов сополимеров Eudragit® для доставки индометацина.
Материалы и методы. Подбор и отработка условий термоэкструзии были проведены с использованием методов реометрии, высокотемпературной микроскопии и модулированной дифференциальной сканирующей калориметрии (мДСК), позволившей смоделировать и воспроизвести условия термоэкструзии. Полученные на одношнековом экструдере гранулы были охарактеризованы с использованием методов мДСК, термогравиметрического анализа (ТГА), ИК- и БИК-спектроскопии. Изучение высвобождения индометацина из гранул в моделирующих продвижение по ЖКТ условиях проводили по методу 2 – «вращающаяся лопасть» согласно ГФ РФ.
Результаты и обсуждение. Термоэкструдированнные гранулы получали из составов бинарных смесей (EPO-ИНД, L100-55-ИНД, ИПЭК (EPO-L100-55)-ИНД), при которых они имели максимальное значение температур стеклования – Тсmax. Для EPO-ИНД оно составило 30/70, а для ИПЭК (EPO-L100-55)-ИНД и L100-55-ИНД – 40/60. Согласно результатам ИК-спектроскопии, образцы термоэкструдатов, содержащие в своем составе ЕРО, а именно ЕРО-ИНД, ФС ЕРО-L100-55-ИНД и ИПЭК-ИНД, характеризуются смещением полосы ИНД с 1689 до 1678 см–1, свидетельствующее о переходе исходной кристаллической формы ИНД в аморфную в результате физико-химического взаимодействия ЕРО с ИНД, что, также, подтверждается результатами термического анализа. Кроме того, у всех термоэкструдированных образцов содержащих ЕРО, ИК-спектры характеризуются появлением полосы при 1570 см–1, подтверждающей образование ионных связей, вследствие взаимодействия ионизированных карбоксильных групп ИНД и L100-55 с диметиламино группами ЕРО. БИК-спектроскопия подтвердила наличие в структуре экструдата на основе ИПЭК (EPO-L100-55)-ИНД как аморфной, так и кристаллической формы γ-формы ИНД, что, по всей видимости, связано с частичным переходом метастабильной аморфной формы в кристаллическую с течением времени. Высвобождение ИНД из экструдатов ЕРО-ИНД при рН 1,2 происходит очень быстро, достигая 100 % в течение получаса. Характер высвобождения ИНД из экструдатов с L100-55-ИНД представляет собой отсрочено-замедленный профиль, контроль скорости выхода которого определяется свойствами формообразующего сополимера (L100-55). Высвобождение ИНД из экструдатов на основе ФС EPO-L100-55-ИНД, как и случае экструдатов ЕРО-ИНД, начинается при рН 1,2, но обеспечивает лишь незначительный выход ЛВ (порядка 30 %). Благодаря содержанию в составе ФС кислотоустойчивого L100-55 стремительный выход ИНД сдвигается из кислой среды (рН = 1,2) в слабокислую (рН = 5,8) обеспечивая 100 % выход ИНД к 2,5 часам эксперимента. Высвобождение ИНД из поликомплексных экструдатов (ЕРО-L100-55)-ИНД характеризуется импульсным профилем высвобождения.
Заключение. В результате исследования методом реактивной термоэкструзии было получено 4 типа гранул с индометацином на основе сополимеров Eudragit® марок ЕРО и L100-55, ИПЭК с их участием и физической смеси, аналогичной ему по составу. Полученные гранулы были охарактеризованы с использованием термических и спектральных методов. Изучение высвобождения индометацина из полученных гранул показало перспективность применения разработанных систем для направленной доставки в различные отделы ЖКТ, начиная от желудка и заканчивая проксимальным отделом толстой кишки.
Введение. Одним из примеров новых полимеров для систем направленной доставки являются цеолиты (ZEO) и цеолитоподобные имидазольные каркасы (ZIF). ZEO, обладающие высокой пористостью, адсорбционной способностью и физико-химической стабильностью, активно используются в промышленности, экологии, фармации и биомедицине. ZIF, как тип металлоорганического каркаса, отличаются высокой термической и химической устойчивостью, биосовместимостью и регулируемой пористостью, что делает их перспективными для доставки лекарств. Оба полимера благодаря своим свойствам открывают новые возможности для создания таргетных препаратов с пролонгированным действием и минимальными побочными эффектами.
Цель данного обзора – охарактеризовать ZEO и ZIF как перспективные полимеры для систем направленной доставки и рассмотреть их основные свойства.
Текст. В статье рассмотрены строение и методы анализа цеолитов и цеолитоподобных имидазольных каркасов, способы их синтеза, механизм действия, области применения полимеров в качестве систем направленной доставки.
Заключение. В обзоре показано, что химические и физические свойства полимеров ZEO и ZIF позволяют разрабатывать эффективные системы направленной доставки лекарственных средств, применяемых в онкологии, офтальмологии, стоматологии и ортопедии. Низкая цитотоксичность, регулируемая загрузка пор полимеров и эффективность внутриклеточного таргетирования подтверждают перспективность использования ZEO и ZIF в медицине.
Введение. Пленкообразующие аэродисперсные системы (ПАС) являются лекарственными формами, образующими in situ пленку при распылении. Одной из ключевых особенностей ПАС является частичная паропроницаемость – частный случай окклюзии. Для оценки паропроницаемости данных систем используются различные методики определения фактора окклюзии, однако на данный момент в исследованиях описаны разрозненные подходы, что не позволяет гармонизировать результаты исследований и описать оптимумы для данного параметра.
Цель. Разработка методики определения паропроницаемости ПАС, измерение фактора окклюзии, а также изучение наиболее значимых факторов, влияющих на точность определения данной характеристики. Материалы и методы. Определение паропроницаемости проводилось с использованием специальной установки, представляющей собой ячейку с водой с закрепленной над ней мембраной, на которую наносился модельный состав ПАС. В качестве ячеек использовались мерные цилиндры объемом 25 мл (Россия) или пенициллиновые флаконы объемом 10 мл с гладким горлом (Россия), в качестве мембран для нанесения ПАС – мембраны для стерилизующей фильтрации (нейлон, ЭПМ. К, OOO НПП «Технофильтр», Россия) и Sartopure® PP3 (полипропилен, Sartorius Stedim Biotech, Германия), диализный мешок MEMBRA-CEL® (ацетат целлюлозы, Viskase Companies, Inc., США). В качестве герметиков, используемых для изолирования воздушных потоков вокруг мембраны, – Parafilm M, C-силикон ZetaPlus L Intro Kit (Zhermack, Польша, Италия), стержневой термоклей Master Hand (Union Source Со., Ltd., Китай), УФ-отверждаемый материал «УНИРЕСТ» (ООО «СтомаДент», Россия). Сравнительный анализ материалов и методов проводился на модельном образце ПАС, содержащем 0,5 % (м/о) Kollicoat® MAE 100P (BASF, Германия), 3 % (м/о) Soluplus® (BASF, Германия), 2 % (м/о) Kollisolv® PEG-400 (BASF, Германия), 70%-й спирт этиловый (СОАО «Ферейн», Беларусь).
Результаты и обсуждение. Комбинация Parafilm M и герметиков показала высокую эффективность герметизации. Для синтетических мембран окклюзионный фактор варьировался в зависимости от типа мембраны от 9,35 ± 3,58 до 16,86 ± 6,09, что отражает низкую или среднюю степень окклюзии модельного состава ПАС и согласуется с опубликованными данными.
Заключение. В ходе исследования удалось разработать оптимизированную методику определения паропроницаемости для ПАС. Было отмечено, что необходим рационализированный подбор мембран, учет вероятности абсорбции влаги мембранами, способ герметизации и калибровки ячейки, уровни температуры и влажности, давление пара.
Введение. В настоящее время широкое распространение получает применение природных биологически активных веществ (БАВ) в качестве эффективных антибактериальных препаратов как для наружного, так и для внутреннего применения. Особый интерес представляет полифенол мангиферин, извлекаемый из листьев растения Mangifera indica. Несмотря на доказанную противомикробную активность в отношении грамположительных и грамотрицательных штаммов бактерий, применение мангиферина ограничено его низкой растворимостью в воде. Для повышения растворимости и, соответственно, биодоступности применяют различные подходы, в частности инкапсулирование в полимерные и биополимерные матрицы. Одним из перспективных биополимеров для инкапсуляции БАВ является гиалуроновая кислота, обладающая полной биосовместимостью с тканями живого организма и способная к полной биодеградации под воздействием ферментов (гиалуронидаз).
Цель. Изучение кинетики высвобождения природного биологически активного соединения мангиферина из полимерной матрицы на основе гиалуроновой кислоты с различной молекулярной массой.
Материалы и методы. Объектами исследования являлись полимерные плёнки, полученные методом полива 1,5 масс.% формовочных растворов гиалуроновой кислоты с молекулярной массой 1,30 и 2,48 МДа с различным содержанием мангиферина. Соотношение гиалуроновой кислоты к мангиферину варьировалось в пределах от 5 до 25 (по массе). Количественное определение высвободившегося мангиферина проводили методом УФ/ВИД-спектрофотометрии при длине волны 237 нм. В качестве модельной среды использовался фосфатный буферный раствор с рН 7,4. Кинетику высвобождения мангиферина оценивали с помощью различных математических моделей.
Результаты и обсуждение. Исследование кинетики высвобождения мангиферина из полимерной матрицы на основе гиалуроновой кислоты показало сигмоидальный характер высвобождения биологически активного агента. Механизм высвобождения имеет сложный характер типа Super Case II transport, за исключением образца с низким содержанием мангиферина и гиалуроновой кислотой 1,3 МДа, для которого обнаруживается аномальный характер высвобождения (диффузия не по закону Фика), что обусловлено гидрофильной природой гиалуроновой кислоты, быстрым набуханием полимерной матрицы, а также значительным опережением темпов диффузии мангиферина по сравнению со скоростью релаксации полимера. Наиболее подходящей является модель Weibull, описывающая кинетику высвобождения мангиферина с большей точностью по сравнению с другими математическими моделями.
Заключение. Полученные результаты свидетельствуют о потенциальной возможности использовать разработанные полимерные плёнки в качестве биомедицинских материалов наружного применения, обеспечивая таким образом трансдермальную доставку лекарственных препаратов. В дальнейшем авторы работы планируют разработать методику обеспечения пролонгированного и контролируемого высвобождения загруженного лекарственного агента, в том числе за счет применения различных сшивающих агентов.
Введение. Одними из самых распространённых бактериальных инфекций являются острый и хронический тонзиллиты: по данным ВОЗ, тонзиллитом в мире страдают от 10 до 15 % взрослых и около 20–25 % детей. Объектом исследования являлась оригинальная субстанция сангвиритрина, содержащая не менее 96,5 % суммы бисульфатов двух алкалоидов – сангвинарина и хелеритрина. В связи с высокой противомикробной активностью сангвиритрина актуальной задачей исследования стало создание системы местной доставки на основе данного лекарственного средства в виде спрея.
Цель. Цель работы – разработка оральной лекарственной формы сангвиритрина для местного применения.
Материалы и методы. В качестве активной фармацевтической субстанции использовали сангвиритрин, разработанный во Всероссийском научно-исследовательском институте лекарственных и ароматических растений. Оценку экспериментальных образцов спрея осуществляли в соответствии с рекомендациями Коллегии Евразийской экономической комиссии от 7 сентября 2018 г. No 17 «О руководстве по качеству лекарственных препаратов для ингаляций и назальных лекарственных препаратов». Изучение органолептических свойств субстанции и образцов спрея проводили по методу А. И. Тенцовой. Местное раздражающее действие спрея оценивали методом конъюнктивальной пробы на кроликах породы шиншилла массой 3,5–4,3 кг. Для количественного определения сангвиритрина в составе лекарственной формы был использован метод спектрофотомерии при длине волны 321 ± 2 нм на спектрофотометре SPECORD® 200 PLUS (Analytik Jena GmbH+Co. KG, Германия). Для разработанного состава в первичной упаковке оценивали показатели качества в соответствии с Государственной фармакопеей РФ XV издания.
Результаты и обсуждение. В результате проведенных измерений технологических показателей спреев был выбран оптимальный состав вспомогательных компонентов, а именно: система растворителей, биоадгезивный компонент и вспомогательные вещества для коррекции вкуса. Основной недостаток имеющейся на рынке лекарственной формы сангвиритрина – это ее жгучий горький вкус. При коррекции органолептических свойств субстанции был обоснован комплексный подход с введением минимального количества подсластителей и дополнительного β-циклодекстрина. Изучение воздействия разработанной лекарственной формы на слизистую оболочку показало, что степень местнораздражающего действия спрея соответствует значению «слабое или отсутствует».
Заключение. Разработана система местной доставки сангвиритрина для лечения инфекционных и воспалительных заболеваний полости рта в виде спрея, принципиально отличающаяся от лекарственной формы, имеющейся на рынке, – раствора для местного и наружного применения. В первую очередь спрей отличается удобством применения для всех возрастных групп, имеет приятный вкус и обладает биоадгезивными свойствами и, соответственно, потребительскими и фармакологическими преимуществами.
Введение. Одним из используемых растительных компонентов в препаратах гепатотропной терапии является силимарин. Силимарин содержится в сухом экстракте семян и плодов расторопши пятнистой (Silybum marianum L. Gaertn.), однако он имеет плохую биодоступность. Последнее обусловлено, в частности, кристаллическим состоянием и низкой растворимостью в воде флаволигнанов силимарина при комнатной температуре, а также их плохой абсорбцией. Одним из методов повышения биодоступности лекарственных веществ является введение их в твердые дисперсные системы (ТДС). Наиболее подходящим методом получения ТДС с экстрактами является метод удаления растворителя, поскольку не требует применения высокого температурного режима в процессе получения ТДС.
Цель. Разработка технологии твердой дисперсионной системы сухого экстракта расторопши методом удаления растворителя для повышения биодоступности данной фитосубстанции.
Материал и методы. Получение твердой дисперсионной системы сухого экстракта расторопши методом удаления растворителя с полимерами поливинилпирролидоном (ПВП К-29/32), поливинилпирролидон-винилацетатом 6: 4 (ПВПВА 64), гидроксипропилметилцеллюлозой (ГПМЦ), желатином и лаурилсульфатом натрия (SDS). Исследование показателей качества ТДС: распределения размера частиц, насыпной плотности, остаточной влажности, гигроскопичности – проведены согласно методикам, приведенным в Государственной фармакопее Российской Федерации (ГФ РФ) XV издания. Количественное определение биологически активных веществ (БАВ) проводили в соответствии с ГФ РФ XV изд. по сумме флаволигнанов в пересчете на силибин.
Результаты и обсуждение. При разработке твердой дисперсионной системы методом удаления растворителя были исследованы образцы ТДС сухого экстракта расторопши (СЭР) с различными полимерами. В результате изучения распределения частиц по размерам был отобран ряд образцов ТДС. Исследования проводили в сравнении с образцом СЭР. Проведение теста «Растворение» показало, что микромизация СЭР в форме ТДС, содержащей в составе поливинилпирролидон-винилацетат – ПВПВА 64, методом удаления растворителя является наилучшим вариантом для увеличения степени высвобождения силибина из экстракта и повышения его биодоступности. По содержанию суммы флаволигнанов в пересчете на силибин отобранный образец ТДС соответствует требованиям НД к сухому экстракту расторопши. Кроме того, условия разработки ТДС не влияют значительно на количественное содержание силибина по сравнению с содержанием его в контрольном образце СЭР. Исследованы технологические показатели ТДС и установлено их качественное улучшение по сравнению с образцом СЭР. Проведена оценка взаимодействия полимера-носителя с сухим экстрактом расторопши методом ИК-Фурье-спектроскопии.
Заключение. Разработана ТДС сухого экстракта расторопши методом удаления растворителя. Для разработанной ТДС были определены такие показатели качества, как содержание суммы флаволигнанов в пересчете на силибин, остаточная влажность, насыпная плотность, распределение размера частиц, гигроскопичность. ТДС сухого экстракта расторопши проанализирована с помощью ИК-Фурье-спектроскопии. Показана физико-химическая совместимость между СЭР и полимером-носителем поливинилпирролидон-винилацетатом. Создание ТДС сухого экстракта расторопши значительно повысило биодоступность фитосубстанции за счет увеличения степени высвобождения силибина из ТДС экстракта – в 3 раза по сравнению с контрольным образцом СЭР.
Введение. Капиллярный электрофорез – метод разделения смеси веществ в поле высокого напряжения. Метод используется для анализа соединений органической и неорганической природы и имеет ряд преимуществ: невысокую стоимость, безопасность, простоту оборудования. Также метод набирает популярность в анализе химического состава растительного сырья.
Цель. Изучение витаминного состава растительного сырья представителей рода Rubus L. методом капиллярного электрофореза.
Материалы и методы. Объектами исследования являлись высушенные листья и/или плоды таких растений, как Rubus caesius L. (ежевика сизая), Rubus nessensis Hall (ежевика несская), Rubus allegheniensis Porter (ежевика аллеганская), Rubus ulmifolius Scott (ежевика вязолистная), Rubus saxatilis L. (костяника), Rubus idaeus L. (малина обыкновенная), Rubus chamaemorus L. (морошка), Rubus arcticus L. (княженика). Обнаружение и количественное определение водорастворимых витаминов проводилось в системе капиллярного электрофореза Капель-104Т (ГК «Люмэкс», Россия). Анализ осуществлялся в варианте капиллярного электрофореза – мицеллярной электрокинетической хроматографии.
Результаты и обсуждение. В заданных условиях анализа удалось идентифицировать 5 витаминов группы В (никотинамид, рибофлавин, пиридоксин, никотиновая кислота, тиамин) и витамин С (аскорбиновая кислота). Содержание витаминов в различных видах сырья варьировалось. Отмечено, что рибофлавин, аскорбиновая и никотиновая кислоты присутствуют практически во всех изучаемых объектах. По количественному содержанию преобладающими витаминами в листьях являются никотинамид, аскорбиновая кислота и пиридоксин, в плодах – аскорбиновая кислота и тиамин. Суммарное содержание витаминов в листьях выше, чем в плодах, что объясняется разными условиями сушки.
Заключение. Методом капиллярного электрофореза удалось обнаружить и провести количественное определение водорастворимых витаминов в раститель=ном сырье на примере некоторых представителей рода Rubus L., некоторые из них – R. caesius L. и R. saxatilis L. – отмечены наибольшим количеством этих соединений.
Введение. Каштан конский (Aesculus hippocastanum L.) – растение, широко использующееся в официальной и народной медицине многих стран. Фармакопейным сырьем в Российской Федерации являются только семена каштана конского. Цветки, благодаря содержащейся в них фракции фенольных производных и тритерпеновых сапонинов, являются перспективным лекарственным растительным сырьем, предположительно обладающим венотонизирующим и мембранопротекторным действием. Для получения лекарственных растительных препаратов на основе цветков каштана конского требуется наличие нормативной документации, содержащей перечень показателей качества, в том числе описание признаков его подлинности (морфологии и анатомии). Одним из передовых методов, широко применяемых в медицине и в последнее время все чаще используемых в фармакогностическом анализе, является растровая электронная микроскопия. В отличие от традиционной световой микроскопии метод дает возможность получить объемное пространственное представление о диагностически значимых признаках лекарственного растительного сырья.
Цель. Целью исследования являлось изучение особенностей морфологии поверхности цветков каштана конского методом растровой электронной микроскопии.
Материалы и методы. Объектом исследования служили высушенные цельные цветки каштана конского обыкновенного (Aesculus hippocastanum L.), собранные в Воронежской области в 2023 году в начале цветения. Кусочки цветков предварительно напыляли кремнием на автоматической напылительной установке Q150R ES (Quorum Technologies Ltd., Великобритания). Микрофотографии получены на электронном микроскопе JSM-6510LV (JEOL Ltd., Япония).
Результаты и обсуждение. Микрофотографии, полученные в ходе анализа, показали диагностически значимые особенности строения цветка: эпидермальные клетки лепестков венчика многоугольные, неправильной формы, некоторые вытянутые, с извилистыми складками. Пыльцевые зерна могут быть собраны в гроздеобразные скопления, располагаться разрозненно или встречаться поодиночке. Поверхность лепестка венчика покрыта многочисленными, часто перекручивающимися волосками, имеющими грубобородавчатую структуру и конусовидное основание с четко выраженным местом крепления. Поверхность тычиночных нитей бороздчатая, с продольными складками с единичными одноклеточными волосками. Пыльник обладает складчатой формой, его поверхность выстилают чешуйчатые эпидермальные клетки с грубыми и утолщенными стенками. Поверхность чашечки, включая цветоножку, также густо опушена многочисленными трихомами.
Заключение. Метод растровой электронной микроскопии впервые использован для изучения морфолого-анатомических признаков цветков каштана конского. Уточнено строение основных диагностически значимых структур данного ЛРС. Определена морфология поверхности эпидермиса лепестков венчика и чашечки, трихом, пыльцевых нитей, пыльников и пыльцевых зерен цветков.
Введение. Несмотря на выраженный терапевтический потенциал, флавоноиды ограниченно используются в медицинской практике в качестве активных фармацевтических субстанций (АФС) ввиду комплекса неудовлетворительных физико-химических свойств. Для изучения данной проблемы в качестве модельного объекта выбрана субстанция кверцетина, обладающая крайне низкой растворимостью в воде и средах желудочно-кишечного тракта (ЖКТ). В связи с этим возникает интерес к исследованию возможности и перспектив применения подхода по улучшению физико-химических свойств флавоноидов на примере кверцетина с использованием технологии экструзии горячего расплава (ЭГР) для создания твердых дисперсных систем (ТДС) на основе гидрофильного полимера-носителя (поливинилпирролидон-винилацетата). Для улучшения свойств растворимости и растворения активного вещества обозначается необходимость подбора эффективного соотношения кверцетина и полимера в составе твердой дисперсии.
Цель. Оценка влияния поливинилпирролидон-винилацетата на свойства водной растворимости кверцетина в составе бинарной твtрдой дисперсии, полученной методом экструзии горячего расплава.
Материалы и методы. Объекты исследования: субстанция кверцетина (субстанция-порошок, содержание 98 %, Molekula Limited, Великобритания) и полимер-носитель в виде сополимера поливинилпирролидона с винилацетатом в соотношении 60: 40 (ПВПВА) марки VIVAPHARM® PVP/VA 64 (JRS PHARMA GmbH & Co. KG, Германия). Получение ТДС кверцетина осуществляли с помощью двухшнекового лабораторного экструдера HAAKE™ MiniCTW (Thermo Fisher Scientific, Германия). Образцы исследовали методами фазово-контрастной микроскопии, ИК-Фурье-спектроскопии и дифференциальной сканирующей калориметрии. Количественное содержание кверцетина в составе твердой дисперсной системы определяли методом УФ-спектрофотометрии.
Результаты и обсуждение. Независимо от концентрации ПВПВА в ТДС для всех составов отмечено улучшение свойств растворимости и скорости растворения кверцетина по сравнению с чистой субстанцией. Обнаружено, что по мере уменьшения содержания кверцетина увеличивается вклад полимера-носителя в ТДС, наблюдается частичная или даже полная аморфизация кверцетина в составах с 1%-м и 5%-м содержанием активного вещества, в результате чего улучшаются свойства водной растворимости, повышается стабильность растворов и скорость растворения образцов в средах желудочно-кишечного тракта. Водная растворимость кверцетина в составе 1%-й ТДС относительно исходной АФС увеличена в 353 раза. При этом в средах, моделирующих отделы ЖКТ, наблюдалось полное высвобождение кверцетина из 1%-й ТДС за 40 минут (для среды хлористоводородной кислоты и цитратного буфера) и растворение 90 % вещества в течение 60 минут в среде фосфатного буфера.
Заключение. На основании проведенного исследования твердая дисперсия, содержащая 1 % кверцетина, на основе поливинилпирролидон-винилацетата является наиболее перспективной для дальнейшей разработки готовых лекарственных форм.
Введение. Симптомы болезни Паркинсона в основном связаны с образованием белковых внутринейрональных включений с тельцами Леви, а также прогрессирующей потерей дофаминергических нейронов черной субстанции (Substantia nigra) и их аксонов. Существующие диагностические критерии для постановки диагноза «болезнь Паркинсона» зачастую учитывают симптомы, возникающие на поздних стадиях заболевания. Таким образом, для более точной постановки диагноза на ранних стадиях необходимо подтвердить патологические изменения в тканях головного мозга методами молекулярной визуализации, такими как позитронно-эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография (ОФЭКТ). При этом ОФЭКТ является более доступным методом диагностики нейродегенеративных заболеваний по сравнению с ПЭТ из-за возможности получения медицинских радионуклидов для визуализации методом ОФЭКТ с помощью мобильных генераторных систем, в частности генератора 99 Mo/ 99m Tc. Среди препаратов на основе 99m Tc и производных тропана, предложенных для визуализации транспортеров дофамина (DAT), наиболее эффективным является [99m Tc]Tc-TRODAT-1 (меченный технецием-99m тропантиол). На данный момент предложены различные составы готовых наборов реагентов в форме лиофилизатов для синтеза [99m Tc]Tc-TRODAT-1, облегчающих процесс его изготовления на месте применения, что вместе с доступностью генератора техенция-99m в медицинском учреждении, а также оптимальной фармакокинетикой делает [99m Tc]Tc-TRODAT-1 препаратом выбора для рутинного применения в клинической практике.
Текст. В данном обзоре были рассмотрены различные подходы к разработке и оптимизации состава готовых наборов реагентов для синтеза [99m Tc]Tc-TRODAT-1 (лиофилизатов), включая количество и соотношение активного вещества и вспомогательных веществ, условия синтеза препарата, в частности температурный режим, время синтеза и pH реакционной смеси.
Заключение. Разработка и оптимизация состава готовых наборов лиофилизатов для синтеза [99m Tc]Tc-TRODAT-1 является актуальной задачей в контексте совершенствования его применения в клинической практике. На основании опубликованных данных прослеживаются четкие зависимости, которые могут лечь в основу дальнейшей разработки и оптимизации состава готовых наборов лиофилизатов для синтеза [99m Tc]Tc-TRODAT-1 для диагностики болезни Паркинсона и других нейродегенеративных заболеваний методом ОФЭКТ в Российской Федерации.
Введение. Рак является основной причиной смертности во всем мире. Нафтохиноны – группа природных органических соединений с широким спектром активности, включающим кардио-, гепато-, нейропротективное действие, а также противомикробную, противовоспалительную и противоопухолевую активность. 1,4-нафтохинон легко поддается окислению, восстановлению, присоединяет нуклеофилы. Простые и хорошо разработанные методы химической модификации нафтохинонов делают их привлекательными для разработки новых соединений. Известно о противоопухолевом действии природных соединений нафтохинона – плюмбагина, шиконина, лапахола. Такие противоопухолевые антибиотики, как доксорубицин, даунорубицин, имеют в своей структуре 1,4-нафтохиноновый фрагмент.
Текст. Настоящий обзор посвящен анализу информации о механизмах противоопухолевого действия синтетических производных 1,4-нафтохинона. Обсуждаются возможные мишени их противоопухолевого действия.
Заключение. Анализ литературных данных показал, что синтетические соединения на основе молекулы 1,4-нафтохинона обладают противоопухолевым потенциалом. Механизм их противоопухолевого действия может быть связан с индукцией апоптоза через сигнальный путь митогенактивируемой протеинкиназы (МАРК) и путь сигнального преобразователя и активатора транскрипции 3 (STAT3), с ингибированием фосфатазы клеточного цикла (Cdc25), накоплением активных форм кислорода (АФК), угнетением ангиогенеза. Данные, полученные исследователями разных стран, подтверждают перспективность поиска новых соединений с противоопухолевой активностью среди синтетических производных 1,4-нафтохинона для разработки на их основе новых лекарственных средств.
Введение. Производство Fc-слитых белков в прокариотических системах приводит к образованию нерастворимых агрегатов из-за неправильного сворачивания полипептидных цепей. Для получения функциональных белков требуется стадия рефолдинга, процесс подбора условий которого может быть трудоемким. Оптимизация параметров ренатурации с помощью подхода дизайна эксперимента (Design of Experiments, DoE) позволяет рассчитать оптимальные параметры процесса и оценить влияние факторов и их взаимодействий.
Цель. Оценка влияния концентраций окислителя, восстановителя и pH буфера ренатурации на эффективность рефолдинга Fc-слитого белка in vitro и определение оптимальных условий.
Материалы и методы. В работе использовали тельца включения Fc-слитого белка, полученные в бактериальной системе экспрессии Escherichia coli BL21. Планирование эксперимента осуществляли с помощью ортогонального композиционного дизайна (Orthogonal Central Composite design, CCO). Дизайн эксперимента, статистическую обработку данных и оптимизацию параметров производили в программе MODDE (v. 12.1, Sartorius Stedim Data Analytics AB, Германия). В качестве откликов использовали показатели хроматографической чистоты и выход целевого белка по данным высокоэффективной жидкостной эксклюзионной хроматографии.
Результаты и обсуждение. Проведена оптимизация условий ренатурации Fc-слитого белка с применением подхода DoE. На основании полученных данных были построены графики поверхности откликов и определены оптимальные значения параметров pH буферной среды, концентрации окислителя и восстановителя. Полученные статистические модели демонстрируют высокую прогностическую способность и воспроизводимость данных. Была проведена успешная валидация процесса рефолдинга в оптимизированных условиях. Наблюдали снижение количества высокомолекулярных примесей и неправильно свернутых форм белка в целевом продукте. Значение хроматографической чистоты целевого белка по данным высокоэффективной жидкостной эксклюзионной хроматографии удалось повысить более чем на 10 %.
Заключение. Было установлено значительное влияние pH буферного раствора, соотношения концентраций окислительно-восстановительной пары и их взаимное влияние на выход и хроматографическую чистоту Fc-слитого белка. Показана тесная взаимосвязь эффектов окислительного и восстановительного компонентов с pH раствора. Повышенный pH буферной среды улучшает растворимость белка, что создает лучшие условия для правильного сворачивания полипептидной цепи.
Введение. Применение метода механохимического синтеза для получения твердых дисперсий (ТД) албендазола (АЛБ) позволило увеличить его антигельминтную активность и биодоступность, а также снизить токсичность, в связи с чем актуальным является вопрос разработки состава и технологии доступного отечественного лекарственного препарата на основе ТД АЛБ в рациональной лекарственной форме (ЛФ).
Цель. Разработка и фармакотехнологическое исследование суспензии для приема внутрь на основе ТД АЛБ, полученной механохимическим твердофазным синтезом.
Материалы и методы. Объектами исследования являлись субстанция АЛБ, сухой экстракт солодки (ЭС) и их ТД, полученные механохимическим твердофазным синтезом в массовом соотношении 1: 5, 1: 10 и 1: 20 при продолжительности механической обработки 2 часа, 8 часов и 16 часов. В качестве вспомогательных веществ использованы вещества, разрешенные для медицинского применения. Исследование растворимости АЛБ из ТД оценивали по содержанию АЛБ в водной среде методом высокоэффективной жидкостной хроматографии. Изучение свойств ТД и полученных ЛФ было проведено в соответствии с требованиями Государственной фармакопеи Российской Федерации (ГФ РФ) XV издания. Результаты и обсуждение. Технологические свойства ТД существенно не изменяются в зависимости от массового соотношения лекарственного вещества (ЛВ) и носителя и времени их механообработки, вследствие чего определяющим фактором выбора оптимальной ТД для разработки ЛФ является значение растворимости АЛБ в воде. Использование метода влажного гранулирования и добавление к ТД наполнителя, стабилизатора и консерванта позволяет получить порошки для приготовления суспензии с удовлетворительными технологическими характеристиками.
Заключение. В ходе исследования были изучены технологические характеристики ТД АЛБ с ЭС, полученных механохимическим твердофазным синтезом, а также определена оптимальная ТД с точки зрения наибольшей растворимости АЛБ в воде. Были подобраны вспомогательные вещества, разработан состав суспензии, восстановленной из гранул ТД АЛБ, с оптимальными технологическими параметрами. Проведены фармакотехнологические исследования суспензий на основе ТД АЛБ.
Введение. Современная фармацевтическая разработка позволяет внедрять в практику все больше новых систем и форм доставки активных компонентов лекарственных средств, усиливающих эффективность их действия по сравнению с традиционными подходами. Современный ритм жизни, обуславливающий зачастую неправильное питание и дисбаланс поступления микронутриентов, приводит к необходимости потребления дополнительных их доз в виде различных аптечных препаратов. Достаточно привлекательными для внедрения в фармацевтическую практику в последние годы становятся спреевые формы витаминов и микроэлементов. Такие готовые формы отличаются доступностью производства, простотой использования, легкостью дозирования и достаточно высокой биодоступностью как у здоровых пациентов, так и лиц, имеющих заболевания желудочно-кишечного тракта и прочие проблемы, связанные с потреблением и усваиванием пищи.
Текст. Доставка лекарств через слизистую оболочку полости рта привлекает все больше внимания из-за ее потенциальных преимуществ по сравнению с другими способами введения. До недавнего времени этот путь рассматривался преимущественно для местного применения, однако в последние годы неуклонно растет количество разработок, связанных с использованием полости рта в качестве портала для доставки активных компонентов лекарственных средств, витаминов и микроэлементов в системный кровоток. Различными научными и клиническими коллективами разработаны и исследованы разнообразные формы оральных препаратов для сублингвального и трансбуккального введения. Особый интерес среди них представляют спреевые формы, как наиболее экономически оправданные и удобные в применении. Наибольший спектр таких разработок касается витамина D и В12, что обусловлено, с одной стороны, наиболее острой проблемой их недостаточности и дефицита среди населения планеты, с другой – низкой биодоступностью, на показатели которой негативно может влиять пищевой рацион, состояние здоровья ЖКТ и прочие факторы. Другие микронутриенты, такие как тиамин, ниацин, пиридоксин, аскорбиновая кислота, кофермент Q и железо, также исследуются и выводятся на рынок в виде оральных спреев для сублингвального применения.
Заключение. Имеющиеся на сегодняшний день результаты разработки и сравнительного анализа оральных форм микронутриентов, в частности данные рандомизированных контролируемых исследований, свидетельствуют об эффективности сублингвального пути введения, которая либо сопоставима, либо превосходит эффективность традиционных путей доставки.
Введение. В последнее десятилетие пептиды с молекулярной массой менее 5 кДа используется в медицине и биотехнологии для лечения различных заболеваний. Химический синтез пептидов имеет ограничения, такие как низкий выход и эффективность синтеза, сложность масштабирования. Альтернативой является использование Escherichia coli. Разработка эффективной технологии синтеза пептидов остается актуальной задачей в связи с низкой продуктивностью штаммов-продуцентов.
Цель. Разработка высокоэффективных штаммов Escherichia coli BL21, экспрессирующих терапевтические пептиды молекулярной массой менее 5 кДа, и технологии их культивирования.
Материалы и методы. Генетические конструкции получили с использованием рестриктазно-лигазного метода, подлинность подтвердили секвенированием по Сенгеру. Технологию культивирования разработали с использованием подхода Design of experiments. Валидацию условий культивирования проводили в биореакторе Biostat B. Гибридные белки очищали методом металл-хелатной хроматографии, целевые пептиды получали гидролизом с помощью ULP-протеазы. Количественное содержание целевого белка определяли капиллярным электрофорезом, подлинность белка – ВЭЖХ-МС и косвенным неконкурентным ИФА. Результаты и обсуждение. В ходе исследований разработаны высокоэффективные штаммы-продуценты пептидов и оптимальные условия культивирования: рН – 7,5 ± 0,5, температура культивирования – 37 °C, оптическая плотность индукции – 2,7 ± 0,3, концентрация ИПТГ – 0,05 мМ. Продуктивность штаммов-продуцентов достигла 4,82 ± 0,05 г/л. Получены образцы очищенных пептидов.
Заключение. Разработанная технология позволяет получить пептиды с высоким выходом, не описанным ранее исследователями. Практическая значимость данной работы заключается в возможности применения данной технологии для получения пептидов с различными физико-химическими свойствами.
Введение. Поиск новых противоопухолевых агентов среди растений местной флоры является одним из вариантов расширения существующего перечня химиотерапевтических лекарственных средств. Перспективным источником таких агентов может являться инвазивный и сорный вид для территории Республики Беларусь и Российской Федерации – борщевик Сосновского. Данный вид содержит кумарины, для которых установлены противоопухолевые свойства, поэтому борщевик Сосновского может считаться перспективным сырьевым источником данных биологически активных веществ.
Цель. Изучить цитостатический эффект извлечений из травы, соцветий и корней борщевика Сосновского на культурах опухолевых клеток in vitro.
Материалы и методы. Объект исследования – воздушно-сухие трава и соцветия, заготовленные в период цветения, и корни, собранные в период отмирания надземной части, борщевика Сосновского. Получали водно-спиртовые извлечения, из которых отгоняли растворитель, полученный сухой остаток растворяли в фосфатно-солевом буфере с рН 7,4. Идентификацию и количественное определение кумаринов проводили методом высокоэффективной жидкостной хроматографии. Противоопухолевый (цитостатический) эффект in vitro изучали на следующих культурах клеток: карциномы легкого А549, аденокарциномы предстательной железы РС-3, меланомы кожи MeWo, аденокарциномы шейки матки Hela и иммортализованных фибробластов крайней плоти BjhTERT. Оценку жизнеспособности клеток выполняли в условиях МТТ-теста на планшетном спектрофотометре. Контроль метаболической активности осуществляли при помощи 4,5-диметилтиазолли-2-ил-2,5-дифенилтетразолия бромида. Формировали отрицательный контроль (буфер), контроль роста клеток, положительный контроль (доксорубицин) и исследуемые пробы.
Результаты и обсуждение. Извлечения из травы борщевика Сосновского проявляли статистически значимый цитостатический эффект в отношении линий опухолевых клеток А549, РС-3, Hela и MeWo; из корней и соцветий – в отношении линий клеток Hela и MeWo. Цитостатический эффект зависел от концентрации кумаринов в пересчете на ксантотоксин. Извлечения из травы оказывают цитостатическое действие на нормальные клетки BjhTERT; корни и соцветия значимо не влияют на их рост. Цитостатический эффект извлечений из травы борщевика Сосновского в отношении клеток линий А549 и РС-3 превосходил, в отношении клеток линий MeWo и BjhTERT сопоставим с доксорубицином. При сравнении полуэффективных концентраций выявлено, что все изученные извлечения вызывают подавление роста в более низких концентрациях, то есть имеют более высокую активность по сравнению с доксорубицином. Извлечения из травы сильнее подавляют рост клеток линии А549; из корней и соцветий – Hela.
Заключение. Трава, корни и соцветия борщевика Сосновского обладают выраженным цитостатическим эффектом in vitro, что делает целесообразным дальнейшее изучение данного растения в рамках выделения кумаринов и установления механизмов влияния на рост опухолевых клеток в сравнении с нормальными.
Введение. Разработка методик анализа новых потенциально активных фармацевтических веществ является важной частью стандартизации субстанций. Комплексный подход к подтверждению структуры вещества является особо важным при возможности существования вещества в разных таутомерных формах, так как свойства вещества могут изменяться в зависимости от таутомерии, влияя в том числе на фармакологическую активность.
Цель. Целью нашего исследования являлось определение таутомерного состава потенциально активной фармацевтической субстанции 5-бутил-6-гидрокси-2,3-дифенилпиримидин-4(3Н)-она в твердом состоянии и растворе для последующей разработки его лекарственной формы и определения биодоступности.
Материалы и методы. Объектом исследования являлась субстанция 5-бутил-6-гидрокси-2,3-дифенилпиримидин- 4(3Н)-она. Для подтверждения структуры снимали спектры: инфракрасный на приборе PerkinElmer Spectrum 3 (PerkinElmer Inc., США) в области частот от 4000 до 400 см –1, ядерного магнитного резонанса 1 H и 13 C на импульсном широкополосном спектрометре Bruker AM-500 (400 и 100 МГц) (Bruker, Германия) в растворителе ДМСО-d 6, ультрафиолетовый с помощью СФ-2000 (ООО «ОКБ Спектр», Россия) в области длин волн 250–400 нм; а также была проведена высокоэффективная жидкостная хроматография с тандемной масс-спектрометрией (ВЭЖХ-МС/МС).
Результаты и обсуждение. Особенностью гидроксипроизводных пиримидина является наличие таутомерных форм, которые могут влиять как на физико-химические свойства вещества, так и на его фармакологическую активность. В ходе исследования было обнаружено, что в твердом состоянии 5-бутил-6-гидрокси-2,3-дифенилпиримидин-4(3Н)-он находится в равновесии между дикето-формой и енольной, а при растворении вещества в диметилсульфоксиде (ДМСО) преобладающей формой является енольная. Методом ВЭЖХ-МС/МС подтверждена чистота.
Заключение. Методами ИК- и ЯМР-спектроскопии была подтверждена структура 5-бутил-6-гидрокси-2,3- дифенилпиримидин-4(3Н)-она. Получены УФ-спектры, а также для исключения возможного поглощения ультрафиолетового излучения примесями была проведена ВЭЖХ-МС/МС.
В четвертой части статьи перечислены основные лекарственные формы, производимые специалистами Аптекарского приказа. Особый интерес представляет анализ документов, впервые опубликованных К. С. Худиным, которые датируются серединой XVII в. В них приведены наименования лекарственных средств, приготовленных аптекарями и алхимистами из растительного и минерального сырья, а также сведения о принятии этих препаратов (водок, масел, мазей, пластырей, сахаров, сиропов, «конфект», бальзамов и прочее) дьяками Аптекарского приказа.
Статистика статьи
Статистика просмотров за 2025 год.
Издательство
- Издательство
- ЦФА
- Регион
- Россия, Москва
- Почтовый адрес
- 117149, Москва, Симферопольский бульвар, 8 ООО "Центр фармацевтической аналитики"
- Юр. адрес
- 117149, г Москва, р-н Зюзино, Симферопольский б-р, д 8, помещ 1/1
- ФИО
- Шохин Игорь Евгеньевич (ГЕНЕРАЛЬНЫЙ ДИРЕКТОР)
- Контактный телефон
- +7 (___) _______