Актуальность. Адекватный контроль болевого синдрома в интраи послеоперационном периоде является важным аспектом в детской кардиохирургии. Применение паравертебральной блокады как метода регионарной анестезии представляет интерес в связи с ограниченным количеством разрешенных обезболивающих препаратов для детей и необходимостью снижения рисков, связанных с использованием опиоидов.
Цель. Оценить эффективность и анальгетический потенциал применения паравертебральной блокады у подростков при операциях на аортальном клапане и корне аорты.
Методы. Проведен ретроспективный анализ данных пяти пациентов в возрасте 14–17 лет, перенесших операции на аортальном клапане и корне аорты. Всем пациентам в дополнение к внутривенному обезболиванию опиоидными анальгетиками выполнена паравертебральная блокада под ультразвуковой навигацией с введением раствора ропивакаина. Оценивались интра- и послеоперационная потребность в опиоидах, интенсивность болевого синдрома и длительность искусственной вентиляции легких в послеоперационном периоде, осложнения, ассоциированные с применением блокады.
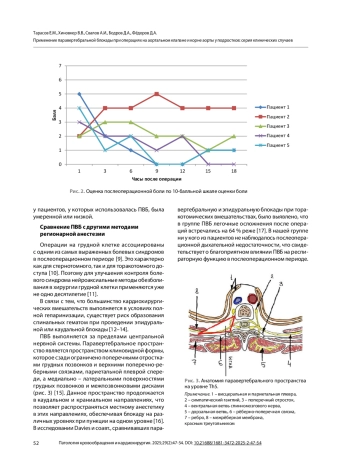
Результаты. У всех пациентов достигнут адекватный контроль болевого синдрома с минимальной потребностью в опиоидах. Интраоперационная потребность в фентаниле составляла 1,67 [1,5; 2,1] мкг/кг/ч. Четверо пациентов (80 %) были экстубированы на операционном столе, один – через 10 минут после транспортировки в отделение реанимации. Медиана послеоперационной боли по 10-балльной шкале составила 2 балла. Послеоперационная доза фентанила составляла 0,83 [0,83; 0,99] мкг/кг/ч. Осложнений, связанных с паравертебральной блокадой, не зафиксировано.
Заключение. Применение паравертебральной блокады в детской кардиохирургии позволяет эффективно купировать болевой синдром, использовать низкие дозы опиоидных анальгетиков и способствовать ранней экстубации трахеи, что ускоряет восстановление пациентов и снижает риск послеоперационных осложнений. Для подтверждения результатов необходимы дальнейшие исследования.
Идентификаторы и классификаторы
Адекватное обезболивание во время и после операции играет важную роль в быстром восстановлении пациентов после операций на сердце и магистральных сосудах [1]. Количество медицинских препаратов, разрешенных к применению в педиатрической практике в Российской Федерации, ограничено, что повышает актуальность мультимодального подхода к аналгезии в интра- и послеоперационном периодах [2].
Список литературы
1. Sahajanandan R., Varsha A.V., Kumar D.S., Kuppusamy B., Karuppiah S., Shukla V., Thankachen R. Efficacy of paravertebral block in “Fast-tracking” pediatric cardiac surgery - Experiences from a tertiary care center. Ann Card Anaesth. 2021 Jan-Mar;24(1):24-29. PMID: 33938827; PMCID: PMC8081147. DOI: 10.4103/aca.ACA8319 EDN: VFDGHD PMID: 33938827
2. Заболотский Д.В., Корячкин В.А., Ульрих Г.Э. Послеоперационная анальгезия у детей. Есть ли доступные методы сегодня? (Современное состояние проблемы). Регионарная анестезия и лечение острой боли. 2017;11(2): 64-72. DOI: 10.18821/1993-6508-2017-11-2-64-72
3. Cox F., Cousins A. Thoracic paravertebral block (PVB) analgesia. J PerioperPract. 2008 Nov;18(11 ):491 -6. PMID: 19051962. DOI: 10.1177/175045890801801104 PMID: 19051962
4. Mehta Y., Arora D., Sharma K.K., Mishra Y., Wasir H., Trehan N.Comparison of continuous thoracic epidural and paravertebral block for postoperative analgesia after robotic-assisted coronary artery bypass surgery. AnnCardAnaesth. 2008 Jul-Dec;11 (2):91 -6. PMID: 18603748. DOI: 10.4103/0971-9784.41576 PMID: 18603748
5. Ender J., Borger M.A., Scholz M., etal. Cardiac Surgery Fast track Treatment in a Postanesthetic Care Unit. Anesthesiology. 2008;109(1):61-66. DOI: 10.1097/ALN.0b013e31817881b3
6. Yamamoto T., Schindler E. Regional anesthesia aspart ofen hance drecovery strategiesin pediatric cardiac surgery. CurrOpinAnaesthesiol. 2023;36(3):324-333. DOI: 10.1097/ATO.0000000000001262
7. Fuller S., Kumar S.R., Roy N., etal. The American Association for Thoracic Surgery Congenital Cardiac Surgery Working Group 2021 consensus document on a comprehensive perioperative approach to enhanced recovery after pediatric cardiac surgery. J ThoracCardiovascSurg. 2021. 162(3): 931 -954. DOI: 10.1016/j.jtcvs.2021.04.072
8. Monahan A., Guay J., Hajduk J., Suresh S. Regional Analgesia Added to General Anesthesia Compared With General Anesthesia Plus Systemic Analgesia for Cardiac Surgery in Children: A Systematic Review and Meta-analysis of Randomized Clinical Trials. AnesthAnalg. 2019;128(1 ):130-136. DOI: 10.1213/ANE.0000000000003831
9. van Gulik, Laura, Ahlers, Sabine J., Brkic, Zina, Belitser, Svetlana V., van Boven, Wim J. van Dongen, Eric P., Knibbe, Catherijne A, Bruins, Peter. Improved analgesia after the realisation of a pain management programme in ICU patients after cardiac surgery. European Journal of Anaesthesiology 27(10):900-905. DOI: 10.1097/EJA.0b013e32833d91c3
10. Mazzeffi M., Khelemsky Y. Poststernotomy Pain: A Clinical Revie. J Cardiothorac Vasc Anesth. 2011;25(6):1163-1178. DOI: 10.1053/j.jvca.2011.08.001
11. Хиновкер В.В. Продленная эпидуральная анальгезия после оперативного лечения сколиоза / В.В. Хиновкер, И.П. Назаров. Анестезиология и реаниматология. 2006; 4:68-70. EDNOTGQEC.
12. Humphreys N., Bays S.M., Parry A.J., etal. Spinal Anesthesia with an Indwelling Catheter Reduces the Stress Response in Pediatric Open Heart Surgery. Anesthesiology. 2005;103(6):1113-1120. DOI: 10.1097/00000542-200512000-00003
13. Thammasitboon S., Rosen D.A., Lutfi R., etal. An institutional experience with epidural analgesia in children and young adults undergoing cardiac surgery. PediatrAnesth. 2010;20(8):720-726. DOI: 10.1111/j.1460-9592.2010.03339.x
14. Hemmerling T., Cyr S., Terrasini N. Epidural catheterization in cardiac surgery: The 2012 risk assessment. Ann CardAnaesth. 2013;16(3):169. DOI: 10.4103/0971-9784.114237
15. Tarasov E.M., Khinovker V.V., Svalov A.I., Koryachkin V.A., & Fedorov, D.A. The use of paravertebral block in pediatric cardiac surgery: narrative review. Regional Anesthesia And Acute Pain Management, (2024);18(4). DOI: 10.17816/RA636547
16. Albokrinov A.A., Fesenko U.A. Spread of dye after single thoracolumbar paravertebral injection in infants: A cadaveric study. Eur J Anaesthesiol 2014;31:305 9.
17. Davies R.G., Myles P.S., Graham J.M. A comparison of the analgesic efficacy and side effects of paravertebral vs. epidural blockade for thoracotomy-A systematic review and meta analysis of randomized trials. Br J Anaesth. 2006;96:418 26.
18. Tham S.Q., Lim E.H.L. Early extubation after pediatric cardiac surgery. AnesthPainMed (Seoul). 2024 Oct;19(Suppl 1):S61-S72. Epub 2024 Jul 24. PMID: 39069653; PMCID: PMC11566561. DOI: 10.17085/apm.23154 PMID: 39069653
19. Corp A., Thomas C., Adlam M. The cardiovascular effects of positive pressure ventilation. BJA Educ 2021; 21: 202-9.
20. Soni N., Williams P. Positive pressure ventilation: what is the real cost? Br J Anaesth. 2008; 101: 446-57.
21. Kintrup S., Malec E., Kiski D., Schmidt C., Brünen A., Kleinerüschkamp F., et al. Extubation in the operating room after fontan procedure: does it make a difference? PediatrCardiol. 2019; 40: 468-76.
22. Barash P.G., Lescovich F., Katz J.D., Talner N.S., Stansel H.C. Jr. Early extubation following pediatric cardiothoracic operation: a viable alternative. AnnThoracSurg. 1980; 29: 228-33.
23. Nawrocki P., Wisniewski K., Schmidt C., Bruenen A., Debus V., Malec E., etal. Extubation on the operating table in patients with right ventricular pressure overload undergoing biventricular repair. Eur J CardiothoracSurg 2019; 56: 904-10.
24. Duncan H.P., Cloote A., Weir P.M., Jenkins I., Murphy P.J., Pawade A.K., etal. Reducing stress responses in the pre bypass phase of open heart surgery in infants and young children: A comparison of different fentanyl doses. Br J Anaesth. 2000;84:556 64.
25. Anand K.J.S., Hickey P.R. Halothane-Morphine Compared with High-Dose Sufentanil for Anesthesia and Postoperative Analgesia in Neonatal Cardiac Surgery // N Engl J Med. 1992; 326(1):1-9. DOI: 10.1056/NEJM199201023260101
26. El Bendary H.M., Abd El Baser II. Bilateral single bupivacaine injection ultrasound guided paravertebral block facilitates early extubation and reduces perioperative opioids requirements in on pump pediatric cardiac surgery. Ain Shams J Anaesthesiol. 2015;8:287 93.
Выпуск
Другие статьи выпуска
Цель. Представить первый клинический опыт применения криобаллонного катетера с регулируемым диаметром POLARx FIT для криобаллонной аблации (КБА) у пациентов с фибрилляцией предсердий (ФП) в Российской Федерации.
Методы. Описаны три клинические процедуры криобаллонной аблации, выполненные у двух пациентов с пароксизмальной ФП и одного пациента с персистирующей ФП. Перед проведением вмешательства была выполнена трансэзофагеальная эхокардиография для исключения наличия внутрисердечных тромбов. Для проведения процедуры КБА использовали катетер с двойным диаметром (28 и 31 мм). Была выполнена изоляция каждой вены с использованием одноразовой аппликации баллона при условии классического впадения легочных вен в левое предсердие, верифицированная флюороскопическим контролем и построением активационных карт левого предсердия. В случае общего коллектора левых легочных вен выполнялась сегментарная пошаговая криоаблация с последующим построением активацонной карты левого предсердия.
Результаты. Все процедуры были успешно выполнены без осложнений. В 100 % случаев была достигнута стабильная изоляция легочных вен. Время до изоляции (TTI) получилось зафиксировать в случаях с 10 из 12 легочных вен. Было отмечено, что использование катетера диаметром 31 мм обеспечивало более антральную изоляцию и облегчало выполнение изоляции у пациента со сложной анатомией впадения легочных вен в левое предсердие.
Заключение. Криобаллонный катетер с регулируемым диаметром POLARx FIT представляется многообещающим нововведением в лечении аритмий. Его способность адаптироваться к различным анатомическим особенностям пациента может улучшить долгосрочные терапевтические результаты.
Актуальность. Операция Дора совершенствуется и внедряется в широкую практику кардиохирургии как наиболее эффективная в восстановлении механической функции левого желудочка сердца после перенесенного массивного инфаркта миокарда. Однако при этом механизмы улучшения коронарного кровотока, динамика состояния аорты и, в частности, ее эластичности при проспективном наблюдении пациентов с коронарным шунтированием и одновременной резекцией и пластикой аневризм левого желудочка практически не изучены.
Целью настоящей работы было, во-первых, изучить средствами МРТ с контрастным усилением изменения биомеханики и насосной функции миокарда левого желудочка в результате выполнения операции Дора; во-вторых, определить характеристики эластических свойств восходящей аорты в динамике операции Дора и их взаимосвязь с улучшением состояния миокарда в результате этого кардиохирургического вмешательства.
Материалы и методы. У 28 пациентов, которым была выполнена операция Дора по поводу обширной постинфарктной аневризмы левого желудочка с коронарным шунтированием, до и после операции было проведено МР-томографическое исследование сердца в покое с определением массы миокарда левого желудочка, показателей конечно-диастолического и конечно-систолического объемов, расчетом объема поврежденной (фиброзной) ткани в исходе перенесенного инфаркта миокарда, а также показателей работы левого желудочка за удар, эластической растяжимости аорты и показателей объема левого предсердия и регургитации на митральном клапане.
Результаты. До операции конечно-диастолический объем левого желудочка (ЛЖ) составлял у всех пациентов > 200 мл за счет того, что 30–40% поверхности левого желудочка составляла трансмурально поврежденная мышечная ткань, т. е. собственно аневризма, которая затем удалялась субтотально в ходе операции Дора. В результате у левого желудочка происходило значительное, более чем на 20% уменьшение конечно-диастолического объема, до величин 175–180 мл. Уменьшалась и масса миокарда левого желудочка с 284 ± 17,9 до 260 ± 17,6 г благодаря резекции большей части аневризмы в ходе операции Дора. При исследовании с контрастным усилением оказалось, что доля повреждения миокарда, т. е. участки фиброза миокарда левого желудочка, статистически значимо уменьшаются в объеме, с 42 ± 7 до 33,8 ± 10 %. Интегральным показателем, верифицирующим улучшение биомеханики левого желудочка, здесь было значительное и статистически значимое увеличение фракции выброса левого желудочка, с прогностически неблагоприятных 42 % в среднем по группе до 48 %, которые ассоциируются с существенно лучшим прогнозом. Коррелировавшее с приростом фракции выброса ЛЖ (r = 0,52, p < 0,05) увеличение индекса отношения работы ЛЖ за удар к конечно-диастолическому объему (Ауд/КДО) также однозначно указывает на выраженную нормализацию регуляции сократимости миокарда левого желудочка по Франку‑Старлингу. Диаметр кольца митрального клапана в результате операции Дора статистически значимо уменьшался (имплантация специализированных протезирующих митральных колец при этом не проводилась) с 31 ± 3,2 до 25 ± 2,8 мм (p < 0,05), а вследствие этого улучшались (снижались) и величины объема левого предсердия с 83,6 ± 23,9 до 68,1 ± 15,1 мл (p < 0,05). Также улучшалась систолическая растяжимость аорты при оценке ее как увеличения объема восходящей аорты в систолу – с 14,9 ± 5,56 до 21,1 ± 4,1 мл (p < 0,05).
Заключение. Операция Дора не только является биомеханически рациональным и обоснованным в своей эффективности вмешательством, улучшающим показатели сократительной функции левого желудочка, но и сопровождается улучшением показателей биомеханики аорты, улучшением систолического растяжения восходящей аорты с последующим диастолическим улучшением коронарного кровоснабжения. Одновременно в результате операции Дора улучшалась гемодинамика митрального клапана – левого предсердия.
Актуальность. В современной литературе нет работ, более глубоко изучающих данную проблему, особенно влияние ишемической болезни сердца (ИБС) и инфаркта миокарда (ИМ) на структуру человеческого перикарда в кардиохирургической практике.
Цель. Оценка влияния ИБС и ИМ на человеческий перикард.
Материалы и методы. Анализировались образцы перикарда от 98 пациентов, перенесших операцию на сердце. Пациенты были разделены на две группы в зависимости от статуса ИБС. Гистологическое исследование образцов перикарда оценивало целостность мезотелия, организацию коллагеновых волокон и воспалительные изменения. Статистический анализ включал тест χ² и анализ с помощью искусственных нейронных сетей (ИНС), который оценивал прогностическую роль ИБС и ИМ в деструкции перикарда.
Результаты. Гистологический анализ выявил выраженные структурные изменения перикарда у пациентов с ИБС и ИМ, включая изменения мезотелия, некроз коллагена и воспалительную инфильтрацию («χ2», p < 0,001), так же и по результатам прогностической модели ИНС (нормализованная важность: ИБС – 100 %; ИМ – 60,8 %). Примечательно, что не было обнаружено гистологических различий между обработанным глутаральдегидом и необработанным перикардом при световой микроскопии.
Выводы. ИБС и ИМ играют важную роль в развитии деструкции перикарда, что может повлиять на результаты хирургического вмешательства при процедуре Озаки. Не было обнаружено значимого влияния обработки глутаральдегидом на микроскопическую структуру аутоперикарда.
Актуальность. При врожденном стенозе аортального клапана у новорожденных необходимо делать выбор: выполнить рентгенэндоваскулярную баллонную дилатацию либо открытую реконструктивную операцию.
Цель. Определить свободу от хирургических вмешательств после эндоваскулярной коррекции клапанного стеноза аорты у новорожденных.
Методы. В данное ретроспективное исследование включены 96 новорожденных, которым в РНПЦ «Кардиология» и РНПЦ детской хирургии была выполнена рентгенэндоваскулярная баллонная дилатация стеноза аортального клапана в период с 2005 по 2025 г. Возраст к моменту эндоваскулярного вмешательства составил 3,0 (1,0–8,0) суток, масса тела – 3,5 (3,2–3,8) кг. Изолированный врожденный стеноз аортального клапана был у 76 (79,2 %) пациентов, сопутствующие врожденные пороки сердца были диагностированы в 20 (20,8 %) случаях. Баллонную дилатацию выполняли пункционным доступом через бедренную артерию, у 1 (1,0 %) недоношенного новорожденного с массой тела 1,7 кг была выделена правая общая сонная артерия.
Результаты. На госпитальном этапе после баллонной вальвулопластики умер 1 (1,0 %) новорожденный, интраоперационное осложнение возникло у 1 (1,0 %) пациента. Повторная рентгенэндоваскулярная баллонная дилатация в связи с сохранением высокого остаточного градиента систолического давления на аортальном клапане была выполнена 25 (26,0 %) детям. Хирургические вмешательства в связи с выраженной недостаточностью аортального клапана после баллонной дилатации выполнили 36 (37,5 %) детям: операция Росса – 11, реконструктивная операция –10, неокуспидализация – 9, протезирование механическим клапаном – 6.
Заключение. Свобода от хирургических вмешательств через 5 лет после эндоваскулярной коррекции клапанного стеноза аорты у новорожденных составила 79,9 %, через 10 лет – 63,8 %.
Издательство
- Издательство
- НМИЦ им. ак. Е.Н. Мешалкина
- Регион
- Россия, Новосибирск
- Почтовый адрес
- 630055, Новосибирская область, город Новосибирск, Речкуновская ул., д.15
- Юр. адрес
- 630055, Новосибирская область, город Новосибирск, Речкуновская ул., д.15
- ФИО
- Чернявский Александр Михайлович (ГЕНЕРАЛЬНЫЙ ДИРЕКТОР)
- E-mail адрес
- mail@meshalkin.ru
- Контактный телефон
- +738 (334) 76099_
- Сайт
- https://meshalkin.ru