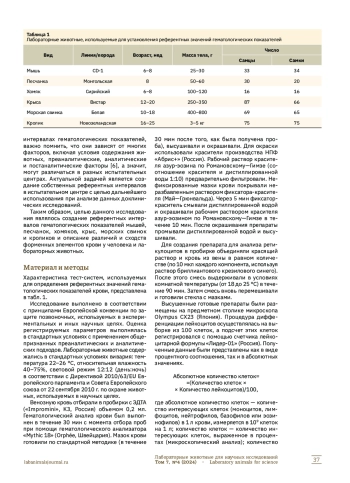
Гематологический анализ, или общий анализ крови, направленный на оценку качественного и количественного состава крови позволяет учитывать широкий спектр показателей. Это один из наиболее простых и часто используемых анализов, позволяющий осуществить мониторинг здоровья лабораторных животных, а также оценивать ход эксперимента. С его помощью можно получить характеристику всех форменных элементов крови: эритроцитов, лейкоцитов и тромбоцитов, оценить их процентное соотношение, форму и вид, обнаружить патологические формы клеток, клеток-предшественников или различные включения. Данный вид анализа может указать на ранние изменения состояния здоровья организма, определить такие состояния, как анемия/полицитемия, тромбоцитопения/тромбоцитоз и лейкопения/лейкоцитоз, которые могут быть симптомами какого-либо заболевания или выступать в качестве самостоятельных патологий. Именно поэтому в каждом научном центре необходимо иметь референтные интервалы гематологических показателей крови здоровых лабораторных животных, учитывающие критические преаналитические, аналитические и постаналитические особенности. Целью данной работы являлось установление референтных интервалов гематологических показателей крови как самцов, так и самок мышей, песчанок, хомяков, крыс, морских свинок и кроликов, как широко используемых тест-систем в биомедицинских исследованиях. Возраст всех животных соответствовал диапазону половой зрелости, в исследование были включены самцы и небеременные и нерожавшие самки без учета фазы менструального цикла. Данные, используемые в работе, были получены от интактных животных за временной период январь—июнь 2024 г. в АО «НПО «ДОМ ФАРМАЦИИ». Вся работа была поделена на два этапа: оценка показателей на гематологическом анализаторе и подсчет лейкоцитарной формулы в ходе микроскопического анализа. В цельной крови животных посредством гематологического анализатора регистрировали такие показатели, как общее число эритроцитов, гематокрит, концентрация гемоглобина, средний объем эритроцитов в общем объеме пробы, среднее содержание гемоглобина в эритроците, средняя концентрация гемоглобина в эритроците, общее число тромбоцитов, общее число лейкоцитов, число лимфоцитов и гранулоцитов. При подсчете лейкоцитарной формулы регистрировались такие показатели, как содержание палочкоядерных и сегментоядерных нейтрофилов, эозинофилов, моноцитов, базофилов и лимфоцитов. При сравнении полученных интервалов с референтными значениями из источников литературы было показано, что в целом диапазоны рассматриваемых показателей схожи, но присутствуют и различия. Наибольшие различия были связаны с количеством эритроцитов, тромбоцитов, моноцитов, лимфоцитов, нейтрофилов и концентрацией гемоглобина. Референтные интервалы, рассчитанные в ходе исследования, могут быть полезным инструментом мониторинга состояния здоровья лабораторных животных в ходе проведения доклинических экспериментов.
Идентификаторы и классификаторы
При проведении разных типов доклинических исследований наиболее часто, до 90%, в качестве тест-систем используют лабораторных грызунов и кроликов [1–4]. Выбор данных видов связан в том числе с тем, что животные имеют небольшой размер тела, короткий репродуктивный цикл и относительно короткую продолжительность жизни.
Список литературы
1. Domínguez-Oliva A., Hernández-Ávalos I., Martínez- Burnes J. et al. The importance of animal models in biomedical research: current insights and applications // Animals. 2023. Vol. 13. N. 7. P. 1223. DOI: 10.3390/ani13071223.
2. Макарова М.Н., Макаров В.Г. Использование песчанок в доклинических исследованиях // Лабораторные животные для научных исследований. 2024. № 1. С. 4–17. [Makarova M.N., Makarov V.G. Ispol’zovanie peschanok v doklinicheskih issledovaniyah // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2024. N. 1. P. 4–17. (In Russ.)]. DOI: 10.57034/2618723X- 2024-01-01.
3. Макарова М.Н., Макаров В.Г. Использование морских свинок в доклинических исследованиях // Лабораторные животные для научных исследований. 2024. № 2. С. 4–26. [Makarova M.N., Makarov V.G. Ispol’zovanie morskih svinok v doklinicheskih issledovaniyah // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2024. N. 2. P. 4–26. (In Russ.)]. DOI: 10.57034/2618723X-2024-02-01.
4. Макарова М.Н., Макаров В.Г. Использование кроликов в доклинических исследованиях // Лабораторные животные для научных исследований. 2023. № 3. С. 18–43. [Makarova M.N., Makarov V.G. Ispol’zovanie krolikov v doklinicheskih issledovaniyah // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2023. N. 3. P. 18–43. (In Russ.)]. DOI: 10.57034/2618723X- 2023-03-02.
5. Hall R.L. Clinical pathology for preclinical safety assessment: current global guidelines // Toxicologic Pathology. 1992. Vol. 20. N. 3–2. P. 472–476.
6. Morton L.D., Sanders M., Reagan W.J. et al. Confounding factors in the interpretation of preclinical studies // International Journal of Toxicology. 2019. Vol. 38. N. 3. P. 228–234. DOI: 10.1177/1091581819837157.
7. Дальнова Т.С., Василиу-Светлицкая С.Г. Клинико-диагностическое значение изменений показателей лейкоцитарной формулы и абсолютного содержания лейкоцитов отдельных видов в пери- ферической крови // Лабораторная диагностика. Восточная европа. 2013. № 1. С. 116–129. [Dal’nova T.S., Vasiliu-Svetlickaya S.G. Kliniko-diagnosticheskoe znachenie izmenenij pokazatelej lejkocitarnoj formuly i absolyutnogo soderzhaniya lejkocitov otdel’nyh vidov v perifericheskoj krovi //Laboratornaya diagnostika. Vostochnaya evropa. 2013. N. 1. P. 116– 129. (In Russ.)].
8. Сорокина А.В., Алексеева С.В., Еремина Н.В. и др. Опыт проведения клинико-лабораторных исследований в доклинической оценке безопасности лекарств (часть 1: гематологические исследования) // Ведомости Научного центра экспертизы средств медицинского применения. 2019. Т. 9. № 3. С. 197–206. [Sorokina A.V., Alekseeva, S.V., Eremina, N.V. et al. Opyt provedeniya kliniko laboratornyh issledovanij v doklinicheskoj ocenke bezopasnosti lekarstv (chast’ 1: gematologicheskie issledovaniya) // Vedomosti Nauchnogo centra ekspertizy sredstv medicinskogo primeneniya. 2019. Vol. 9. N. 3. P. 197–206. (In Russ.)]. DOI: 10.30895/1991-2919-2019-9-3-197-206.
9. Мирошников М.В., Султанова К.Т., Ковалева М.А. и др. Вариабельность биохимических показателей крови и установление референтных интервалов в доклинических исследованиях. Сообщение 6: Яванские макаки // Лабораторные животные для научных исследований. 2022. № 2. С. 14–25. [Miroshnikov M.V., Sultanova K.T., Kovaleva M.A. et al. Variabel’nost’ biohimicheskih pokazatelej krovi i ustanovlenie referentnyh intervalov v doklinicheskih issledovaniyah. Soobshchenie 6: YAvanskie makaki // Laboratornye zhivotnye dlya nauchnyh issledovanij. 2022. N. 2. P. 14–25. (In Russ.)]. DOI: 10.29296/2618723X- 2022-02-02.
10. Pilny A.A. Clinical hematology of rodent species // Veterinary clinics of North America: exotic animal practice. 2008. N. 11(3). P. 523–533.
11. Marshall K.L. Rabbit hematology // Veterinary clinics of North America: exotic animal practice. 2008. N. 11(3). P. 551–567.
12. Siegel A., Walton R.M. Hematology and Biochemistry of small mammals // Ferrets, Rabbits, and Rodents. 2020. P. 569.
13. Lindstrom N.M., Moore D.M., Zimmerman K. et al. Hematologic assessment in pet rats, mice, hamsters, and gerbils: blood sample collection and blood cell identification // The veterinary clinics of North America. Exotic animal practice. 2015. Vol. 18. N. 1. P. 21–32.
14. Wozniak D.M., Kirchoff N., Hansen-Kant K. et al. Hematology and clinical chemistry reference ranges for laboratory- bred natal multimammate mice (Mastomys natalensis) // Viruses. 2021. Vol. 13. N. 2. P. 187.
15. Schnell M.A., Hardy C., Hawley M. et al. Effect of blood collection technique in mice on clinical pathology parameters // Human gene therapy. 2002. Vol. 13. N. 1. P. 155–161.
16. Wolford S.T., Schroer R.A., Gohs F.X. et al. Reference range data base for serum chemistry and hematology values in laboratory animals // Journal of Toxicology and Environmental Health, Part A Current Issues. 1986. Vol. 18. N. 2. P. 161–188.
17. McKeon G.P., Nagamine C.M., Ruby N.F. et al. Hematologic, serologic, and histologic profile of aged Siberian hamsters (Phodopus sungorus) // Journal of the American Association for Laboratory Animal Science. 2011. Vol. 50. N. 3. P. 308–316.
18. Giknis M.L.A., Clifford C.B. Clinical laboratory parameters for Crl: WI (Han) rats // Accel Drug Dev. 2008. P. 1–14.
19. Spittler A.P., Afzali M.F., Bork S.B. et al. Age- and sexassociated differences in hematology and biochemistry parameters of Dunkin Hartley guinea pigs (Cavia porcellus) // Plos one. 2021. Vol. 16. N. 7. P. e0253794. DOI: 10.1371/journal.pone.0253794.
20. Kitagaki M., Yamaguchi M., Nakamura M. et al. Agerelated changes in haematology and serum chemistry of Weiser–Maples guineapigs (Cavia porcellus) // Laboratory animals. 2005. Vol. 39. N. 3. P. 321–330.
21. Zimmerman K., Moore D.M., Smith S.A. Hematological assessment in pet guinea pigs (Cavia porcellus): blood sample collection and blood cell identification // The veterinary clinics of North America. Exotic animal practice. 2015. Vol. 18. N. 1. P. 33–40. DOI: 10.1016/ j.cvex.2014.09.002.
22. Poljičak-Milas N., Kardum-Skelin I., Vuđan M. et al. Blood cell count analyses and erythrocyte morphometry in New Zealand white rabbits // Vet. Arhiv. 2009. Vol. 79. P. 561–571.
23. Казакова М.С., Луговская С.А., Долгов В.В. Референсные значения показателей общего анализа крови взрослого работающего населения // Клиническая лабораторная диагностика. 2012. № 6. С. 43–49. [Kazakova M.S., Lugovskaya S.A., Dolgov V.V. Referensny eznacheniya pokazatelej obshchego analiza krovi vzroslogo rabotayushchego naseleniya // Klinicheskaya laboratornaya diagnostika. 2012. N. 6. P. 43–49. (In Russ.)].
24. Rodnan G.P., Ebaugh F.G., Fox M.S. et al. The life span of the red blood cell and the red blood cell volume in the chicken, pigeon and duck as estimated by the use of Na2Cr51O4: with observations on red cell turnover rate in the mammal, bird and reptile // Blood. 1957. Vol. 12. N. 4. P. 355–366.
25. Thrall M.A., Weiser G., Allison R.W. et al. Veterinary hematology and clinical chemistry. John Wiley & Sons, 2012.
26. Абрашова Т.В., Гущин Я.А., Ковалева М.А. и др. Физиологические, биохимические и биометрические показатели нормы экспериментальных животных // Справочник. Санкт-Петербург: ЛЕМА, 2013. 116 c. [Abrashova T.V., Gushchin Ya.A., Kovaleva M.A. et al. Fiziologicheskie, biohimicheskie i biometricheskie pokazateli normy eksperimental’nyh zhivotnyh // Spravochnik. Sankt-Peterburg: LEMA, 2013. 116 p. (In Russ.)].
27. Полозюк О.Н., Ушакова Т.М. Гематология: учебное пособие // Персиановский: Донской ГАУ, 2019. 159 c. [Polozyuk O.N., Ushakova T.M. Gematologiya: uchebnoe posobie // Persianovskij: Donskoj GAU, 2019. 159 p. (In Russ.)].
28. Анисимова О.О., Морылева О.Н. Лабораторная диагностика, микроскопия нативной крови. 2010. 40 с. [Anisimova O.O., Moryleva O.N. Laboratornaya diagnostika, mikroskopiya nativnoj krovi. 2010. 40 p. (In Russ.)].
29. Washington I.M., Van Hoosier G. Clinical biochemistry and hematology // The laboratory rabbit, guinea pig, hamster, and other rodents (Academic Press). 2012. Р. 57–116.
30. Batchelder M., Keller L.S., Sauer M.B. et al. Gerbils // The laboratory rabbit, guinea pig, hamster, and other rodents (Academic Press). 2012. Р. 1131–1155.
31. Kuznetsova E.V., Feoktistova N.Y., Naidenko S.V. et al. Seasonal changes in blood cells and biochemical parameters in the Mongolian hamster (Allocricetulus curtatus) // Biology Bulletin. 2016. Vol. 43. P. 344–349.
32. Кравченко И.Н., Хохлова О.Н., Кравченко Н.Н. и др. Гематологические показатели свободных от патогенной флоры крыс CD (Sprague Dawley) и мышей CD 1 в норме // Биомедицина. 2008. № 2. С. 20–30. [Kravchenko I.N., Hohlova O.N., Kravchenko N.N. et al. Gematologicheskie pokazateli svobodnyh ot patogennoj flory krys CD (Sprague Dawley) i myshej CD 1 v norme // Biomedicina. 2008. N. 2. P. 20–30. (In Russ.)].
33. Santos E.W., de Oliveira D.C., Hastreiter A. et al. Hematological and biochemical reference values for C57BL/6, Swiss Webster and BALB/c mice // Brazilian Journal of Veterinary Research and Animal Science. 2016. Vol. 53. N. 2. Р. 138–145.
34. Moore D.M., Zimmerman K., Smith S.A. Hematological assessment in pet rabbits: blood sample collection and blood cell identification // Veterinary Clinics: Exotic Animal Practice. 2015. Vol. 18. N. 1. Р. 9–19.
35. He Q., Su G., Liu K. et al. Sex — specific reference intervals of hematologic and biochemical analytes in Sprague-Dawley rats using the nonparametric rank percentile method // PloS one. 2017. Vol. 12. N. 12. P. e0189837.
36. Delwatta S.L., Gunatilake M., Baumans V. et al. Reference values for selected hematological, biochemical and physiological parameters of Sprague-Dawley rats at the Animal House, Faculty of Medicine, Universityof Colombo, Sri Lanka // Animal Models and Experimental Medicine. 2018. Vol. 1. N. 4. P. 250–254. DOI: 10.1002/ame2.12041.
37. O’Connell K.E. et al. Practical murine hematopathology: a comparative review and implications for research // Comparative medicine. 2015. Vol. 65. N. 2. P. 96–113.
38. Zamora-Bello I., Hernandez-Baltazar D., Rodríguez-Landa J.F. et al. Optimizing rat and human blood cells sampling for in silico morphometric analysis // Acta Histochemica. 2022. Vol. 124. N. 6. P. 151917.
39. Kuhn G., Hardegg W., Noack S. et al. Long-term effects of hysterectomy and bilateral oophorectomy on lymphoid tissue in female Lewis rats // Veterinary immunology and immunopathology. 1991. Vol. 29. N. 3–4. P. 353–363.
40. Popoiu S., Teodoru A., Levandovschi N. et al Hematological and biochemical dynamics of rabbits and guinea pigs used for scientific purposes at cantacuzino institute, Bucharest // Romanian Journal of Veterinary Medicine. 2021. Vol. 31. N. 2. P. 69–80.
41. Leineweber C., Müller E., Marschang R.E. Blood reference intervals for rabbits (Oryctolagus cuniculus) from routine diagnostic samples // Tierärztliche PraxisAusgabe K: Kleintiere/Heimtiere. 2018. Vol. 46. N. 6. P. 393–398.
42. Kornmann L.M., Zernecke A., Curfs D.M. et al. Echogenic perfluorohexane-loaded macrophages adhere in vivo to activated vascular endothelium in mice, an explorative study // Cardiovascular ultrasound. 2015. Vol. 13. P. 1–8.
43. Lester V.K., Tarpley H.L., Latimer K.S. Small mammal hematology: Leukocyte identification in rabbits and guinea pigs // Dept. of pathology (tarpley, latimer) college of veterinary medicine. University of Georgia, Athens. 2005.
44. de Kort M., Weber K., Wimmer B. et al. Historical control data for hematology parameters obtained from toxicity studies performed on different Wistar rat strains: Acceptable value ranges, definition of severity degrees, and vehicle effects // Toxicology Research and Application. 2020. Vol. 4. P. 1–32. DOI: 10.1177/2397847320931484.
45. Bailly Y., Duprat P. Normal blood cell values, rat // Hemopoietic system. 1990. Р. 27–38.
46. Okamura T., Suzuki S., Ogawa T. et al. Background data for general toxicology parameters in RccHanTM: WIST rats at 8, 10, 19 and 32 weeks of age // Journal of toxicologic pathology. 2011. Vol. 24. N. 4. P. 195–205.
47. Lee J.J., Jacobsen E.A., Ochkur S.I. et al. Human versus mouse eosinophils: “that which we call an eosinophil, by any other name would stain as red” // Journal of allergy and clinical immunology. 2012. Vol. 130. N. 3. P. 572–584.
Выпуск
Другие статьи выпуска
Цель работы — изучить реабсорбцию белков в почках озерных лягушек (Pelophylax ridibundus) при гиперволемии, дегидратации и действии аргинин-вазотоцина (АВТ), антидиуретического гормона амфибий. Использовали методы иммуногистохимии, конфокальной микроскопии и автоматизированного анализа флуоресцентных сигналов. На фиксированных препаратах почек регистрировали свечение в проксимальных канальцах рецептора эндоцитоза мегалина и введенных белков — лизоцима и зеленого флуоресцентного белка (GFP). Рассчитывали интенсивность сигналов, число флуоресцентных канальцев и эндоцитозных везикул, а также процент колокализации белков с мегалином. Дегидратация и инъекции АВТ приводили, как правило, к снижению показателей реабсорбции. Данные сопоставлены со сходными эффектами гипернатриемии, а также с показателями крови и функции почек, продемонстрированными ранее у лягушек в аналогичных экспериментальных условиях. Можно полагать, что у лягушек увеличение концентрации осмотически активных веществ в крови и первичной моче, а также уменьшение скорости клубочковой фильтрации приводит к снижению захвата и скорости внутриклеточного транспорта белков в клетках проксимальных канальцев.
Интенсивность исследований и применения природного биологически активного вещества муцина улиток в фармакологии и косметологии сегодня позволяет говорить о его масштабной отраслевой потребности в ближайшем будущем. В связи с этим актуальна разработка высокопроизводительных методов получения улиточной слизи, предполагающих многократную экстракцию секрета на протяжении жизни моллюска без причинения вреда его физиологическому состоянию. В работе предложен и исследован способ нетравмирующего воздействия на моллюсков, позволяющий стимулировать секреторную функцию животных и повысить производительность получения муцина. На примере улиток вида Helix pomatia с помощью разработанного и изготовленного опытного образца устройства для получения муцина в лабораторных условиях подтверждена возможность применения пульсирующего светодиодного излучения в видимом диапазоне спектра в качестве нетравмирующего воздействия, повышающего производительность получения секрета. Установлен наиболее эффективный режим светового воздействия. Показана эффективность сочетания пульсирующего светового воздействия с другим нетравмирующим фактором — механическим воздействием текстуры опорной поверхности на ногу моллюска. Приведены фото, иллюстрирующие основные конструктивные и исполнительные узлы (корпус, крышка-шасси, плата контроллера, светодиодный светильник, опорная пластина с ребристой поверхностью) экспериментального устройства для получения муцина.
Для обеспечения комфортного содержания лабораторных яванских макак, которые играют важную роль в доклинических исследованиях, необходимо уделить внимание нескольким ключевым аспектам. Важно обеспечить подходящее для данного вида животных размещение, устанавливать и контролировать оптимальные параметры микроклимата мест содержания, составлять сбалансированный по необходимым нутриентам рацион кормления, подбирать и предоставлять различные виды среды обогащения, а также учитывать особенности репродуктивной системы для успешного воспроизводства животных и получения здорового потомства.
Поиск публикаций выполняли в базах данных PubMed и Google Scholar. В обзор включали публикации, доступные для поиска на 09.07.2024 г. В результате настоящего обзора были обозначены и обобщены данные литературы по лабораторным яванским макакам, которые описывают условия размещения животных; допустимые параметры микроклимата в местах содержания (температура, влажность, кратность воздухообмена, освещенность и цикл освещения); предоставление различных видов обогащения среды; характерное поведение макак в популяции; особенности репродуктивной системы самцов и самок; половое поведение животных в период садки, включая оптимальный период для их спаривания; период беременности и родов; особенности макак в уходе за потомством. При анализе данных литературы были собраны основные рекомендации по содержанию яванских макак с учетом всех зоотехнических потребностей при их размещении и воспроизводстве.
Доклиническую оценку специфической активности инфузионных растворов проводят на крупных лабораторных животных, использование которых в скрининговых исследованиях затруднено в связи с большими материальными и временными затратами. В настоящее время коллективом авторов (Шперлинг И. А. и др.) разработана модель острой кровопотери на крысах, в которой критериями специфической активности инфузионных растворов рассматриваются расчетные показатели: приведенный ударный объем крови (ПУдОК) и показатель эффективности инфузии (ПЭИ). Данные показатели рассматриваются в качестве косвенных аналогов ударного объема сердца — основного показателя функции сердечной деятельности. Динамика данных показателей позволяет комплексно оценить эффективность механизмов поддержания гемодинамики при острой кровопотере и ее восполнении в скрининговых исследованиях на мелких лабораторных животных. В связи с этим проведено исследование с целью определения возможности использования приведенного ударного объема крови и показателя эффективности инфузии в качестве критериев оценки специфической активности инфузионных растворов на модели острой кровопотери у крупных лабораторных животных. Содержание животных и все манипуляции с ними одобрены локальным этическим комитетом. У наркотизированных (внутримышечно золетил 100; ингаляционно изофлуран) самцов свиней (массой около 50 кг) проводили эксфузию крови через яремную вену в объеме 45–50% объема циркулирующей крови (ОЦК) (исходя из ОЦК, равного 7% массы животного) со скоростью 50 мл/мин до установления стойкой артериальной гипотензии. Далее животные были распределены на 2 группы по 10 особей: контрольную (без инфузии) и опытную (восполнение ОЦК реополиглюкином, который вводили в яремную вену через 15 мин после окончания эксфузии крови). В динамике эксперимента регистрировали частоту сердечных сокращений (ЧСС) и среднее артериальное давление (АДср), проводили ЭхоКГ, измерение ударного объема (УО) крови, рассчитывали ПУдОК и ПЭИ. Статистический анализ полученных данных выполняли с помощью программного обеспечения Statistica 10.0. Сравнительный анализ позволил установить тесную корреляционную связь между исследуемыми показателями гемодинамики (ПУдОК и ПЭИ) и УО, измеренным с помощью ЭхоКГ. На основе полученных результатов дополнительно разработаны прогностические признаки благоприятного и неблагоприятного течения периода острой кровопотери. Рассмотренные в настоящем исследовании расчетные показатели (ПУдОК и ПЭИ) являются корректными индексами, отражающими гемодинамику при острой кровопотере и эффективность ее компенсации вливанием инфузионных растворов. Данные показатели не требуют фактического подтверждения УО крови, являющегося одним из ключевых показателей эффективности деятельности сердца, и могут быть использованы в экспериментах по оценке специфической активности инфузионных растворов на модели острой кровопотери у крупных лабораторных животных, в частности, свиней.
Мочекаменная болезнь (уролитиаз) характеризуется образованием минерализованных конкрементов в мочевыводящих путях и является одним из самых распространенных заболеваний современного человека. Физико-химические реакции, составляющие основу патогенеза формирования камней, а также роль регулирующих молекул в данном процессе до конца не изучены, что затрудняет разработку эффективных лекарственных препаратов для лечения и профилактики данной патологии и в то же время обусловливает актуальность исследования возможных моделей уролитиаза на лабораторных животных. В данной работе представлены результаты моделирования мочекаменной болезни у самцов крыс и кроликов при помощи введения этиленгликоля (ЭГ) с питьевой водой. ЭГ обладает литогенным действием, поскольку в результате его метаболизма синтезируется большое количество оксалат-ионов, которые, соединяясь с ионами кальция в моче, образуют нерастворимые соли. Возможность формирования патологии исследовали в следующих режимах дозирования индуктора: введение крысам 1% ЭГ в течение 28 дней (n=20) и 1,5% ЭГ в течение 9 дней (n=20); кроликам 1,5% ЭГ в течение 28 дней (n=16) и 4% ЭГ в течение 13 дней (n=16). В рамках данной работы у всех экспериментальных животных регистрировали потребление воды, массу тела, проводили ежедневное клиническое наблюдение, в сыворотке крови оценивали уровень альбумина, общего белка, кальция, фосфора, мочевины, креатинина, аланинаминотрансферазы, аспартатаминотрансферазы, щелочной фосфатазы и лактатдегидрогеназы, в пробах мочи исследовали содержание кристаллов, креатинина, мочевины, белка и кальция. Почки крыс и кроликов подвергались гистологическому исследованию. На основании полученных данных проведена оценка эффективности формирования уролитиаза у крыс и кроликов в исследованных режимах, по результатам которой наиболее удачным признано введение 1% ЭГ крысам в течение 28 дней. При необходимости использовать кроликов в качестве тест-системы следует помнить о слабой выраженности отклонений лабораторных параметров от физиологической нормы.
Одним из актуальных направлений при изучении механизмов развития патологий, возможности тестирования новых фармакологических препаратов, а также внедрении альтернативных способов терапии болезней является использование лабораторных животных, среди которых чаще всего выбираются грызуны. Расстройства аутистического спектра требуют изучения не только генетических и нейробиологических механизмов возникновения, но и возможности ранней диагностики и облегчения симптоматики. Цель представленной работы — провести обзор имеющихся методов создания экспериментальных моделей расстройств аутистического спектра и современных тестов, необходимых для оценки поведенческих паттернов животных при проведении биомедицинских исследований по изучению аутизма. Поиск источников литературы осуществляли в базах данных PubMed и РИНЦ по следующим словарным запросам: «расстройства аутистического спектра», «модели на грызунах», «поведенческие модели», «фармакологические модели расстройств аутистического спектра», «autism», «autism spectrum disorder» и др. Временной горизонт поиска распространялся на 2016–2023 гг. Рассмотрены современные подходы к моделированию расстройств аутистического спектра на грызунах. Отдельное место занимает описание фармакологических и поведенческих моделей. Большое внимание уделяется комплексному изучению поведения животных для оценки степени выраженности симптомов аутизма, а именно нарушений социального поведения, проявлений стереотипного поведения и расстройств коммуникационных способностей.
Катехол-О-метилтрансфераза (KОМТ) является одним из основных ферментов млекопитающих, участвующих в метаболизме катехоламинов, таких как дофамин, норадреналин. Процесс метаболизма катехоламинов важен для регуляции нормального функционирования нервной системы, включая эмоции и реакции на стресс. Участие KОМТ в функционировании нервной системы делает животных с инактивированным геном comt удобной моделью для изучения психических расстройств. С помощью CRISPR/Cas9-технологии была создана новая линия мышей с нокаутом гена comt. Измерение концентрации нейромедиаторов и их метаболитов в стриатуме и префронтальной коре у мышей с нокаутом гена comt и мышей дикого типа проводили методом высокоэффективной жидкостной хроматографии с использованием внутреннего стандарта 2,3-дигидроксибензойной кислоты, не встречающейся в нативной ткани, в концентрации 100 нг/мл. У гомозиготных мышей с нокаутом гена comt наблюдалось отсутствие гомованилиновой кислоты — конечного продукта метаболизма дофамина в префронтальной коре и стриатуме, в то время как уровень промежуточного продукта 3,4-дигидроксифенилуксусной кислоты был выше. Уровень норадреналина в префронтальной коре оказался выше, тогда как в стриатуме достоверных различий между нокаутными мышами и мышами дикого типа не обнаружено. Несмотря на соответствующие изменения в метаболитах катехоламинов, концентрации серотонина и дофамина значительно не различались между группами мышей с нокаутом гена comt и мышей дикого типа.
Статистика статьи
Статистика просмотров за 2025 год.
Издательство
- Издательство
- НПО ДОМ ФАРМАЦИИ
- Регион
- Россия, Санкт-Петербург
- Почтовый адрес
- 188663, Ленинградская обл, Всеволожский р-н, гп Кузьмоловский, ул Заводская, д 3 к 245, ком 4/34
- Юр. адрес
- 188663, Ленинградская обл, Всеволожский р-н, гп Кузьмоловский, ул Заводская, д 3 к 245, ком 4/34
- ФИО
- Макарова Марина Николаевна (ДИРЕКТОР)
- Контактный телефон
- +7 (___) _______