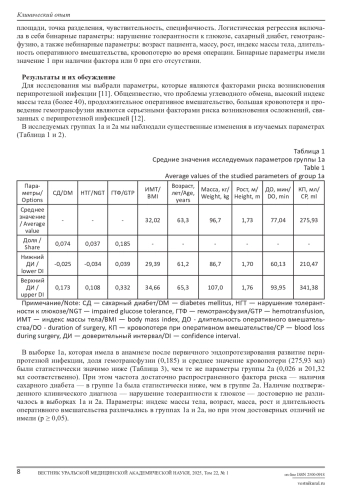
При операциях эндопротезирования острой проблемой остается возникновение перипротезной инфекции (ППИ). Оценка рисков развития ППИ крайне актуальна для ЛПУ всех уровней. Цель исследования: оценить возможности прогнозирования развития перипротезной инфекции на основе антропометрических и клинико-лабораторных данных пациента, а также некоторых количественных параметров оперативного вмешательства. Материалы и методы. Проведен ретроспективный анализ историй болезни с глубиной поиска 13 лет. В исследование включено 65 мужчин, 98 женщин; средний возраст пациентов 65±9лет. Пациенты были разделены на 2 группы. Пациентам первой группы осуществляли первичное эндопротезирование, а после манифестации инфекции они находились на лечении в клинике гнойной остеологии ФГБУ «НМИЦ ТО имени академика Г. А. Илизарова». У пациентов второй группы не выявлено развития ППИ в течении 5 лет после первичного эндопротезирования. Для оценки достоверности результатов исследования использовались критерий Вилкоксона, χ-критерий, критерий Пури-Сена-Тамуры. Прогностическую значимость параметров оценивали на основе сравнения площадей под ROC-кривой. Для исследования были выбраны значимые с точки зрения клинического значения параметры: нарушение углеводного обмена, высокий индекс массы тела, продолжительность оперативного вмешательства, большая кровопотеря и проведение гемотрансфузии. Результаты. Посчитаны средние значения параметров для небинарных выборок и доли для бинарных. С помощью критерия Вилкоксона и χ-критерия выявлены статистически значимые различия между пациентами, в анамнезе которых имелась манифестация ППИ и без таковой в периоде 5 лет после эндопротезирования. Проведен многомерный анализ критерием Пури-Сена-Тамуры и выявлены различия между группами. Построена логистическая регрессия. Заключение. Определены параметры, влияющие на возникновение ППИ: наличие сахарного диабета, гемотрансфузии, объема кровопотери в ходе оперативного вмешательства. Несмотря на небольшое количество значимых параметров, для оценки риска манифестации перипротезной инфекции показана возможность прогнозирования развития ППИ, в том числе посредством логистической регрессии.
Идентификаторы и классификаторы
Несмотря на значительную рутинизацию операций эндопротезирования, острой проблемой остается возникновение перипротезной инфекции(ППИ) [1]. Комплексные подходы к профилактике ППИ не исключают ее возникновения. Кроме того, значительную роль в ее развитии играют не только иммунный статус пациента, но и его социальный статус, а также антропометрические параметры и анамнез, отягощенный вредными привычками [2]. Рецидивы возникновения ППИ составляют около 50% [3], при этом многоэтапность оперативного вмешательства приводит к многократному увеличению расходов на лечение пациента. Также стоит учитывать социальную опасность возникновения перипротезной инфекции и ее последствий, приводящих к значительным рискам инвалидизации пациента и его смерти [4]. Проблема хирургических вмешательств является остросоциальной и ее актуальность не вызывает сомнений [5]. Оценка рисков развития ППИ крайне актуальна для ЛПУ всех уровней организации — от базовых до специализированных и высокотехнологичных. Расчетные методы позволяют оценить шансы наступления негативных последствий, однако в арсенале клиницистов отсутствуют стандартизированные подходы к оценке рисков [6]. Разработка шкал рисков требует длительного ретроспективного анализа, что вносит определённые трудности в осуществление таких проектов.
Список литературы
1. Павлов В.В., Петрова Н.В., Шералиев Т.У. Среднесрочные результаты двухэтапного лечения перипротезной инфекции. Травматология и ортопедия России. 2019;25(4):109-116. doi:10.21823/2311- 2905-2019-25-4-109-116
2. Венедиктова А.А., Квашнина Д.В., Благонравова А.С. Факторы риска развития перипротезной инфекции по данным систематического обзора. Медицинский альманах. 2018;4(55):133-137.
3. Грищук А.Н., Леонова С.Н., Камека А.Л. Оценка рисков развития и рецидива инфекционного процесса при первичном и ревизионном эндопротезировании коленного сустава. Acta biomedica scientifica. 2021;6(4):202-212. doi:10.29413/ ABS.2021-6.4.18
4. Артюх В.А., Божкова С.А., Тихилов Р.М., Ярмилко А.В., Муравьева Ю.В. Факторы риска летального исхода после хирургического лечения больных хронической перипротезной инфекцией тазобедренного сустава. Гений ортопедии. 2021;27(5):555-561. doi: 10.18019/1028-4427-2022-28-6- 842-851
5. Колюшин Н.М., Каминский А.В., Абабков Ю.В., Ермаков А.М. Результат эндопротезирования тазобедренного сустава после септического артрита. Гений ортопедии. 2013;(4):103-105.
6. Стогов М.В., Овчинников Е.Н. Лабораторные методы диагностики и оценки риска осложнений после эндопротезирования крупных суставов. Аналитический обзор. Гений ортопедии. 2016;(3):87 93. doi:10.18019/1028-4427-2016-3-87-93
7. Гланц С. Медико-биологическая статистика. Практика. 1998:459.
8. Козлов Н.Е., Сорохтин Н.О., Мартынов Е.В., Марчук Т.С. Особенности формирования супра- комплексов Кейвского домена. Вестник МГТУ. 2021;24(1):35—45. doi:10.21443/1560-9278-2021- 24-1-35-45
9. Ковалев А.А., Кузнецов Б.К., Ядченко А.А., Игнатенко В.А. Оценка качества бинарного классификатора в научных исследованиях. Проблемы Здоровья и Экологии. 2020;(4):105—113.
10. Гадиева В.А., Брин В.Б. Содержание аминотиолов у крыс с ишемически-реперфузионным по- вреждением почек в сочетании с ртутной нефропатией. Вестник новых медицинских технологий. Электронное издание. 2019;4. doi:10.24411/2075-4094-2019-16434
11. Тряпичников А.С., Камшилов Б.В., Колотыгин Д.А., Белокрылов Н.М. Результаты двухэтапного эндопротезирования у пациентов с перипротезной инфекцией тазобедренного сустава (ретроспективное когортное исследование). Гений ортопедии. 2022;28(2):173-178. doi:10.18019/1028- 4427-2022-28-6-842-851
12. Слободской А.Б., Осинцев Е.Ю., Лежнев А.Г., Воронин И.В., Бадак И.С., Дунаев А.Г. Факторы риска развития перипротезной инфекции после эндопротезирования крупных суставов. Вестник травматологии и ортопедии им. Н.Н. Приорова. 2015;(2):13-18.
Выпуск
Другие статьи выпуска
Внедрение новой модели поликлиники на принципах бережливого производства способствует повышению качества и доступности медицинской помощи в первичном звене. Цель работы: оценить уровень внедрения новой модели в подразделениях медицинских организаций, оказывающих первичную медико-санитарную помощь Красноярского края в зависимости от территориальной удаленности от регионального центра. Материал и методы. Источником информации явились сводные данные статистических форм Красноярского края за период с 2019 по 2024 год. В исследовании приняли участие 111 подразделений медицинских организаций, оказывающих медицинскую помощь взрослому и детскому населению Красноярского края, которые на протяжении изучаемого периода внедряли новую модель. Результаты и обсуждение. Установлено, что на уровень внедрения новой модели влияет степень урбанизации местности расположения подразделения медицинской организации (p<0,001) и возрастная категория прикрепленного населения (p<0,001). Подразделения медицинских организаций, находящиеся на расстоянии более 250 км от Красноярска, статистически значимо в меньшем объеме участвуют в проектной (p<0,05) деятельности, достижении критериев второго, третьего уровней новой модели (p<0,05) и блока дополнительных критериев входной зоны (p<0,001). Проведенный корреляционный анализ данных между территориальной удаленностью подразделения медицинской организации от регионального центра и уровнем внедрения в нем новой модели указывает на обратную статистически значимую линейную связь средней силы (r=–0,430, p<0,001). Заключение. Высокий уровень внедрения новой модели в подразделениях медицинских организаций на расстоянии 0-25 км от регионального центра обусловлен расположением в условиях крупного города, предоставляющим больше возможностей для повышения квалификации, обмена знаниями и актуальной информацией, а также снижением временных и транспортных затрат. Низкий уровень внедрения новой модели в сельской местности может быть следствием дефицита кадров, ограниченно развитой инфраструктуры. Недостаточный уровень внедрения новой модели и ведения проектной деятельности, недостижение 2, 3 уровня и блока дополнительных критериев входной зоны в подразделениях медицинских организаций, расположенных на расстоянии более 250 км от регионального центра вызвано территориальной отдаленностью от регионального центра и, как следствие, невозможностью осуществления очных контрольных мероприятий, низкой степенью вовлеченности сотрудников данных подразделений из-за слабого ресурсного, кадрового, информационного и коммуникационного обеспечения.
Цель исследования. Анализ практического опыта Тюменского регионального медицинского общества по страхованию гражданской ответственности медицинских организаций – членов общества. Рассмотрение примеров страховых случаев, связанных с претензиями пациентов к медицинским организациям Тюменской области, урегулированных по действующему договору коллективного страхования гражданской ответственности медицинских организаций – членов Тюменского регионального медицинского общества. Материалы и методы. В качестве материала для исследования были выбраны собственные данные о претензиях третьих лиц (пациентов или их родственников) к медицинским организациям Тюменской области, ответственность которых была застрахована в рамках договора коллективного страхования. Период анализа: 2016-2023 годы. Рассмотрен общий порядок работы с жалобами и претензиями пациентов, приведен анализ ряда случаев из практики Тюменского регионального медицинского общества, которые привели к выплате возмещения вреда, причиненного пациентам и их родственникам. Даны практические рекомендации по выбору условий страхования гражданской ответственности. Заключение. В статье показана актуальность механизма страхования гражданской ответственности как способа защиты имущественных интересов медицинских организаций, связанных с претензиями пациентов. Практический опыт Тюменского регионального медицинского общества показывает, что наличие договора страхования ответственности позволяет снизить финансовую нагрузку на медицинские организации и существенно упростить процедуру урегулирования претензий пациентов.
Цель исследования: оценить динамику распространенности заболеваемости первичными злокачественными новообразованиями печени и внутрипеченочных желчных протоков среди населения Свердловской области за прошедшие пятнадцать лет. Материалы и методы: использовались данные Свердловского областного Канцер-регистра, информационной базы Региональной онкологической системы (ОНКОР). Данные по Российской Федерации и Уральскому Федеральному округу получены из общедоступного источника – книг Злокачественные новообразования в России за 2007-2022 годы. Использован статистический и аналитический методы. Выводы. В результате пятнадцатилетнего наблюдения установлено, что в Свердловской области в целом уровень заболеваемости первичными злокачественными опухолями печени и внутрипеченочных желчных протоков имел негативную динамику в виде роста стандартизованного показателя. Кроме того, в изучаемом регионе регистрировалось ежегодное превышение стандартизованного показателя по сравнению со среднероссийскими значениями.
Цель исследования. Построение нейросетевой мультитаргетной регрессионной модели зависимости SERT-аффинитета химических соединений от энергий их докинга в релевантные биомишени, анализ чувствительности полученной модели и выявление ключевых биомишеней, наиболее существенно влияющих на аффинность соединений к серотониновому транспортеру. Материалы и методы. Данные по 2D-структуре и SERT-ингибирующей активности 3436 известных соединений и препаратов; 478 3D-моделей белков мишеней человека, релевантных SERT-ингибирующей активности; 10 оригинальных и лицензионных компьютерных программ. Проводилось построение оптимизированных 3D-моделей SERT-ингибирующих соединений и препаратов; определение биомишеней, релевантных SERT-ингибирующей активности; нахождение сайтов связывания и валидных 3D-моделей этих биомишеней; проведение ансамблевого докинга известных SERT-ингибиторов в релевантные биомишени, вычисление минимальных энергий докинга, формирование обучающей выборки; обучение и тестирование регрессионных нейронных сетей, выбор лучшей нейросети; анализ чувствительности нейросетевой мультитаргетной модели, выявление ключевых биомишеней, существенно влияющих на SERT-аффинность. Результаты. Определена 21 биомишень, релевантная SERT-ингибирующей активности, выявлено для них 25 сайтов связывания, найдены 68 валидных 3D моделей. Выполнен ансамблевый докинг известных SERT-ингибиторов в релевантные биомишени, сформирована обучающая выборка. Обучено 7500 нейросетей, построена регрессионная нейросетевая модель зависимости SERT-аффинности соединений от их аффинности к 24 сайтам 20 релевантных биомишеней, имеющая коэффициент корреляции RTotal=0,885 и статистическую достоверность p<5·10ˉ⁷. Проведен анализ чувствительности этой модели, выявлены 12 ключевых биомишеней, наиболее существенно влияющих на SERT-аффинность. Выводы. С использованием методов искусственного интеллекта найдены 12 ключевых биомишеней, наиболее существенно влияющих на аффинность к SERT, из которых шесть мишеней характеризуются положительным влиянием (ADRA1A, AMPA, DRD1, GAT1, HTR2A-Alo, HTR3A) и шесть мишеней характеризуются отрицательным влиянием (HTR2C, JAK2, MAPK11, NMDA-Block, ROCK2, SLC18A2). Указанные биомишени отражают мультитаргетный механизм серотонинергической регуляции клеточного стресса при воспалении и различных функциональных расстройствах.
Введение. Ранее при исследовании резорбтивного действия сернистого иприта было показано формирование синдрома кишечной недостаточности. Очевидно, что при выраженных нарушениях моторно-эвакуаторной, секреторно-абсорбционной и пищеварительной функций кишечника в значительной степени меняется среда обитания населяющей его микробиоты и создаются предпосылки для формирования дисбиоза. Вместе с тем, в научной литературе отсутствуют какие-либо клинические и экспериментальные данные, относящиеся к микробиологическим исследованиям желудочно-кишечного тракта (ЖКТ) при интоксикации ипритом. Цель — исследование качественно-количественного состава микробиоты ЖКТ у крыс при ипритной интоксикации. Материалы и методы. Опыты выполняли на крысах-самцах линии Wistar, которые были распределены на группы: контроля (интактные крысы) и опытную. Животным опытной группы внутримышечно вводили иприт в дозе 4,0 мг/кг, составляющей 1,0 ЛД50. Через 3 сут на пике интоксикации у животных отбирали биоптаты слизистой оболочки желудка, тощей и слепой кишок, а также просветное содержимое слепой кишки. Выделение и идентификацию микроорганизмов проводили стандартными бактериологическими методами. Результаты. Анализ результатов проведённого исследования позволяет констатировать выраженные нарушения микроэкологического гомеостаза ЖКТ при воздействии иприта. Высказанный тезис подтверждается снижением количества доминирующей нормофлоры (Lactobacillus spp. и Bifidobacterium spp.) в желудке, тонкой и толстой кишках, а также избыточным ростом и увеличением частоты высеваемости условно-патогенной микрофлоры (Escherichia coli, Enterococcus spp. и Candida spp.) в пристеночном муцине ЖКТ крыс на пике ипритной интоксикации. Заключение. Выявленные нарушения микроэкологического гомеостаза ЖКТ в условиях иммуносупрессии и компрометации энтерогематического барьера могут обусловливать нарушения жизненно важных функций организма и являться существенными патои танатогенетическими механизмами ипритной интоксикации. В этой связи фармакологическую коррекцию микроэкологических нарушений ЖКТ следует рассматривать перспективным направлением патогенетической терапии интоксикации, обусловленной резорбтивным действием иприта.
На сегодняшний день для определения тактики лечения рака молочной железы (РМЖ) в стандарт диагностических мероприятия обязательно включено определение статуса рецептора эпидермального фактора роста человека 2 типа (HER2). Для определения HER2-статуса используется метод иммуногистохимического исследования и метод флуоресцентной гибридизации in situ (FISH) с двойным зондом. Последний метод также помогает обнаружить количественные изменения в 17 паре хромосом, где находится ген HER2. Клиническая значимость увеличения сигналов центромеры хромосомы 17 (CEP17), помимо ее использования в тесте HER2 ISH (гибридизация in situ) полностью не изучена. Таким образом, актуальным остается проведение исследований, оценивающих связь между увеличением центромерных сигналов 17 хромосомы (CEP17) и статусом HER2 в реальной клинической практике.
Цель исследования. Оценить частоту встречаемости «полисомии» хромосомы 17 (увеличения числа СЕР17) c использованием 2 зондов при инвазивном раке молочной железы в зависимости от клинико-патологических характеристик (возраст, сохранность менструальной функции, Her2/ neu-статус, молекулярный тип опухоли, стадия заболевания). Материалы и методы. В ретроспективное исследование включено 40 больных с первичной инвазивной карциномой молочной железы, проходивших лечение на базе НИИ онкологии Томского НИМЦ. Her2-статус оценивался с помощью методов иммуногистохимии и FISH-реакции согласно критериям ASCO/CAP 2023. Увеличение сигналов центромеры CEP17 характеризует увеличение числа данной хромосомы, которая наблюдается при истинной полисомии 17 или полиплоидии. В связи с этим, в данной работе под термином «полисомия 17 хромосомы» мы будем рассматривать увеличения числа СЕР17. «Полисомия 17» регистрировалась при количестве сигналов CEP17≥3 на ядро опухолевой клетки. Пациентки, у которых определялась полисомия 17 хромосомы, были включены в основную группу, без полисомии – в группу сравнения. Оценка частоты встречаемости «полисомии 17 хромсомы» производилась по основным клининическим и патологическим характеристикам, таким как возраст, поражение лимфатических узлов, степень дифференцировки, стадия, биологический подтип, сохранность менструальной функции. Достоверность различий оценивали по точному критерию Фишера (F). Различия считали статистически значимыми при уровне значимости р≤0,05. Результаты. Из 40 пациенток, включенных в исследование, полисомия хромосомы 17 встречалась у 7 больных РЖМ, что составило 17,5%. При анализе Her2-статуса не было обнаружено расхождений между данными ИГХ и FISH. В группе с полисомией 17 хромосомы отмечается гетерогенность результатов ИГХ тестирования. Так, в 10% случаев выявлена полисомия хромосомы 17 с гиперэкспрессией белка HER2, но без амплификации гена. При сопоставлении клинико-патологических данных статистически значимые отличия были по сохранности менструальной функции (р<0,05) на момент постановки диагноза. Полисомия 17 хромосомы чаще встречалась при сохранной менструальной функции. Вывод. При определении HER2-статуса методом FISH необходимо использовать системы с двумя зондами не только в качестве контроля, но и для определения плоидности 17 хромосомы. Это может быть полезно для выявления подгрупп пациентов с раком молочной железы, имеющих генетические и клинические особенности. Связь между полисомией хромосомы 17 и сохранностью менструальной функции делает дальнейшие исследования данного хромосомного нарушения важным.
Введение. Меланома занимает пятое место по распространенности среди всех видов ЗНО в мире, демонстрируя стремительный рост уровня заболеваемости за последние 10 лет. Тенденция к увеличению распространенности данного ЗНО, росту его устойчивости к существующим методам терапии и, как следствие, росту смертности от меланомы указывает на необходимость рассмотрения новых терапевтических подходов, одним из которых является использование электромагнитных полей низкой частоты (ЭМП-НЧ). Ранее уже была продемонстрирована способность ЭМП ингибировать рост популяции клеток меланомы, однако в данной работе впервые было исследовано влияние ЭМП на линию меланомы с использованием чрезвычайно (крайне) низкой частоты – 5 Гц. Цель исследования – определить характер влияния электромагнитного поля (5 Гц) на функциональное состояние клеток меланомы B16-F10. Материалы и методы. Клетки линии меланомы B16-F10 были облучены ЭМП с частотой 5 Гц в 3 режимах работы (5 А монополярный положительный – 20 А монополярный отрицательный – 30 А биполярный) в течение 1 – 2 – 3 часов. Было проанализировано функциональное состояние клеток после облучения ЭМП методом проточной цитометрии. Произведен обзор актуальной научной литературы по исследуемой теме. Результаты. В режиме работы генератора ЭМП 2 при экспозиции 2 часа – увеличение некротических клеток на 100% (p<0,001). В режиме 3, экспозиция 3 часа – увеличение клеток в состоянии апоптоза на 24% с выраженной дозозависимостью (p<0,05). Заключение. Настоящее исследование подтвердило, что воздействие ЭМП-НЧ (5 Гц) является перспективным подходом к лечению меланомы. Предположительно, наблюдаемый эффект (индукция гибели онкоклеток) реализуется за счет изменения внутриклеточного гомеостаза Ca²⁺, что требует дальнейших исследований.
Хроническое воспаление мочевого пузыря полиэтиологично, но имеет общую патогенетическую платформу, связанную с нарушением состоятельности уретелиального барьера (УБ), способствующего проникновению токсинов мочи на различные уровни клеточных образований стенки. Целью исследования явилось изучение возможности клинической оценки ультраструктурного и молекулярно-клеточного состояния МТБ мочевого пузыря методом сканирующей электронной микроскопической (СЭМ) и позитронно-эмиссионной (ПЭТ/КТ) томографии с 11С-холином. Материалы и методы. Проведены сравнительные исследования результатов ЭМС и ПЭТ/КТ состояния МТБ у 2 женщин трудоспособного возраста до и через 12 месяцев после проведения дистанционной лучевой терапии (ДЛТ) рака шейки матки в стадии TIIN0M. Результаты. В результате анализа СЭМ и ПЭТ/КТ изображения эпителиального слоя мочевого пузыря пациентки без урологического анамнеза до проведения ДЛТ выявлена его плотно упакованная структура с показателем стандартизированного уровня захвата 11С-холина ( SUVmax) 5,44 у. е. Через 12 месяцев безрецидивного периода основного заболевания обнаружена деформация уротелия с формированием межклеточных каналов, что совпадало с увеличением SUVmax на 57,9%. Результаты анализа СЭМ и ПЭТ/КТ изображения поверхностного слоя мочевого пузыря пациентки с рецидивирующим циститом (РЦ) до проведения ДЛТ позволили визуализировать незначительное расширение межклеточного пространства, сопровождающееся увеличением SUVmax на 12,5% выше показателя при неотягощенном урологическом анамнезе. Через 12 месяцев на фоне безрецидивного периода основного заболевания при проявлениях ПЛЦ наблюдалось дальнейшее расширение межклеточного пространства с увеличением SUVmax в 5 раз относительно показателя ПЛЦ без сопутствующего РЦ. Заключение Показатель ПЭТ/КТ стандартизированного уровення захвата 11С-холина (SUVmax) в стенке мочевого пузыря может отражать ультраструктурное состояние мочетканевого барьера, что нуждается в дальнейшем изучении и уточнении.
При операциях эндопротезирования острой проблемой остается возникновение перипротезной инфекции (ППИ). Оценка рисков развития ППИ крайне актуальна для ЛПУ всех уровней. Цель исследования: оценить возможности прогнозирования развития перипротезной инфекции на основе антропометрических и клинико-лабораторных данных пациента, а также некоторых количественных параметров оперативного вмешательства. Материалы и методы. Проведен ретроспективный анализ историй болезни с глубиной поиска 13 лет. В исследование включено 65 мужчин, 98 женщин; средний возраст пациентов 65±9лет. Пациенты были разделены на 2 группы. Пациентам первой группы осуществляли первичное эндопротезирование, а после манифестации инфекции они находились на лечении в клинике гнойной остеологии ФГБУ «НМИЦ ТО имени академика Г. А. Илизарова». У пациентов второй группы не выявлено развития ППИ в течении 5 лет после первичного эндопротезирования. Для оценки достоверности результатов исследования использовались критерий Вилкоксона, χ-критерий, критерий Пури-Сена-Тамуры. Прогностическую значимость параметров оценивали на основе сравнения площадей под ROC-кривой. Для исследования были выбраны значимые с точки зрения клинического значения параметры: нарушение углеводного обмена, высокий индекс массы тела, продолжительность оперативного вмешательства, большая кровопотеря и проведение гемотрансфузии. Результаты. Посчитаны средние значения параметров для небинарных выборок и доли для бинарных. С помощью критерия Вилкоксона и χ-критерия выявлены статистически значимые различия между пациентами, в анамнезе которых имелась манифестация ППИ и без таковой в периоде 5 лет после эндопротезирования. Проведен многомерный анализ критерием Пури-Сена-Тамуры и выявлены различия между группами. Построена логистическая регрессия. Заключение. Определены параметры, влияющие на возникновение ППИ: наличие сахарного диабета, гемотрансфузии, объема кровопотери в ходе оперативного вмешательства. Несмотря на небольшое количество значимых параметров, для оценки риска манифестации перипротезной инфекции показана возможность прогнозирования развития ППИ, в том числе посредством логистической регрессии.
Статистика статьи
Статистика просмотров за 2025 год.
Издательство
- Издательство
- ИИФ УрО РАН
- Регион
- Россия, Екатеринбург
- Почтовый адрес
- 620078, г. Екатеринбург ул. Первомайская, д.106
- Юр. адрес
- 620078, г. Екатеринбург ул. Первомайская, д.106
- ФИО
- Соловьева Ольга Эдуардовна (Директор)
- E-mail адрес
- secretar@iip.uran.ru
- Контактный телефон
- +7 (834) 3374007